
| A. | 8种 | B. | 10种 | C. | 11种 | D. | 12种 |
分析 能与NaHCO3溶液反应生成CO2,说明此分子含有羧基,分子式为C5H8O2说明此分子含有碳碳双键,然后根据官能团的位置异构和碳链异构确定,还可能是环状结构.
解答 解:由该有机物的化学性质和组成判断其含有碳碳双键和羧基,当没有支链时,其碳骨架有3种,CH2=CH2CH2CH2COOH,CH3CH=CHCH2-COOH,CH3CH2CH=CHCOOH,有一个甲基做支链的结构有四种,CH2=CH(CH3)CH2COOH,CH2=CH2CH(CH3)COOH,CH3CH2=C(CH3)-COOH,CH2=CH-CH(CH3)-COOH,CH2=C(CH2CH3)COOH,四个碳原子碳环接羧基一种,三个碳原子有3种,羧基和甲基可以在同一个碳上,可以在不同的碳上,可以是-CH2COOH,总共12种.
故选D.
点评 本题考查同分异构体的书写,难度不大,通过性质判定含有的官能团,通过碳链异构和位置异构确定有机物种数.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ② | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH 溶液:H+、A13+、Al(OH)3 | |
| B. | 在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 在含有等物质的量的MgCl2、NH4Cl的溶液中加入NaOH溶液:NH4Cl、MgCl2 | |
| D. | 在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极的电极反应式:Li-e-═Li+ | |
| B. | 充电时,LiFePO4既发生氧化反应又发生还原反应 | |
| C. | 该电池不能用水溶液作为电解质 | |
| D. | 放电过程中Li+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
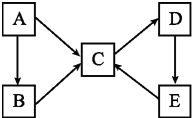 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
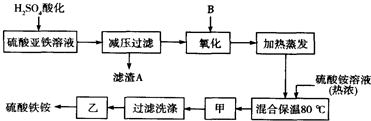
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com