
| A. | 1:1:1 | B. | 4:2:1 | C. | 2:3:4 | D. | 3:3:4 |
科目:高中化学 来源: 题型:选择题
| A. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| B. | 在一定条件下可实现下列转化MgCl2(溶液)→Mg(OH)2→MgO | |
| C. | 通过置换反应可实现由Mg到MgO的转化 | |
| D. | 镁与稀硝酸反应的离子方程式为:Mg+2H+═Mg+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键是由两个p电子“肩并肩”重叠形成的 | |
| B. | σ键和π键都是共价键,σ键比π键更稳定 | |
| C. | 乙烯分子中的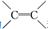 和乙炔分子中的-C≡C-都是π键 和乙炔分子中的-C≡C-都是π键 | |
| D. | H2分子中含有σ键,HCl分子中含π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦⑨ | B. | ②④⑧⑩ | C. | ①③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 酒精灯内酒精不能多于酒精灯容积的2/3 | |
| C. | 实验结束后将试管清洗干净 | |
| D. | 胶头滴管不能交叉使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼(N2H4)的性质类似于氨气,易溶于水,是塑料、橡胶发泡剂的原料.将肼蒸气通入Cu0胶体中,可发生如图所示的转化.
肼(N2H4)的性质类似于氨气,易溶于水,是塑料、橡胶发泡剂的原料.将肼蒸气通入Cu0胶体中,可发生如图所示的转化.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| B. | 手机上用的锂离子电池属于二次电池 | |
| C. | 燃料电池能把化学能转化成电能 | |
| D. | 已知反应2CO(g)=2C(s)+O2(g)的△H>0、△S<0,那么高温下可自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com