
| A. | 国际单位制的一个基本物理量 | B. | 表示物质质量的单位 | ||
| C. | 物质的量的单位 | D. | 表示物质数量的单位 |
科目:高中化学 来源: 题型:实验题
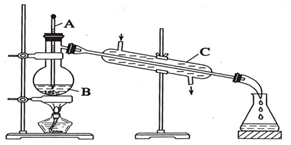 工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.回答下列问题
工业上通常用工业酒精和生石灰混合蒸馏法制取无水乙醇.如图是实验室中模拟工业原理制取无水乙醇的装置.回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目标物质和杂质 | 检验方法 | 除杂方法 |
| A | FeCl2(FeCl3) | 滴入KSCN | 通入过量氯气 |
| B | NaCl(NH4Cl) | 加热 | 加热 |
| C | KNO3(NaCl) | 焰色反应(透过蓝色钴玻璃) | 重结晶 |
| D | Cl2(HCl) | 通入AgNO3溶液 | 通入饱和NaCl溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 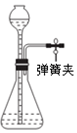 打开弹簧夹,由漏斗中加水至产生液面差,液面高度差不变时,说明装置气密性良好 | |
| B. |  打开弹簧夹一段时间后,红墨水倒吸入导气管中,说明铁钉发生了析氢腐蚀 | |
| C. | 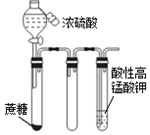 滴入浓硫酸后一段时间,高锰酸钾溶液褪色,说明产生了还原性气体 | |
| D. | 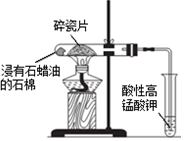 加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 3mol/L的KCl溶液 | B. | 30mL 1mol/L的NaCl溶液 | ||
| C. | 30mL 3mol/L的FeCl3溶液 | D. | 10mL3mol/L的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何浓度的溶液都可以用pH来表示其酸碱性的强弱 | |
| B. | 某溶液中由水电离出的c(OH-)=1×10-a mol•L-1,若a>7,则该溶液的pH一定为14-a | |
| C. | 0.2 mol•L-1 CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| D. | 无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)•c(OH-)=1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边搅动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.
乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边搅动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com