
 .
.分析 (1)一般来说,活泼金属与非金属形成离子键,非金属元素之间形成共价键,含有离子键的化合物属于离子化合物,只含有共价键的化合物属于共价化合物,先判断化合物的类型,再根据书写规则书写电子式;
(2)原子符号中左上角的数字为质量数,左下角的数字为质子数,质子数+中子数=质量数.
解答 解:①Ar中不存在化学键,属于单质;
②HCl只存在共价键,属于共价化合物;
③NH4Cl存在离子键和共价键,属于离子化合物;
④N2只存在N≡N共价键,属于单质;
⑤Na2O2存在离子键和共价键,属于离子化合物;
⑥NaF中只含有离子键,属于离子化合物;
⑦H2O 只存在共价键,属于共价化合物;
⑧KOH 存在离子键和共价键,属于离子化合物;
只存在共价键的化合物是②⑦;只存在离子键的是的是⑥; 既存在极性键又存在离子键的是③⑧;
Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ;
;
故答案为:②⑦;⑥;③⑧; ;
;
(2)${\;}_{6}^{14}$C中质量数为14,质子数为6,中子数为8,
${\;}_{7}^{14}$N中质量数为14,质子数为7,中子数为7,
${\;}_{8}^{16}$O中质量数为16,质子数为8,中子数为8,
${\;}_{17}^{35}$Cl中质量数为35,质子数为17,中子数为18,
${\;}_{92}^{235}$U中质量数为235,质子数为92,中子数为143,
${\;}_{92}^{238}$U中质量数为238,质子数为92,中子数为146,
则${\;}_{6}^{14}$C、${\;}_{7}^{14}$N的质量数相等,但不能互称为同位素;${\;}_{6}^{14}$C、${\;}_{8}^{16}$O的中子数相等,但质子数不相等,所以不是同一种元素;
故答案为:${\;}_{6}^{14}$C、${\;}_{7}^{14}$N;${\;}_{6}^{14}$C、${\;}_{8}^{16}$O.
点评 本题考查化学键、电子式的书写、原子结构,把握化学键形成的一般规律为解答的关键,注意特殊物质中的化学键(铵盐、氯化铝)即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | S2-的电子排布式为1s22s22p63s23p6 | |
| B. | 26号元素的电子排布式为[Ar]3d64s2 | |
| C. | 基态C原子的轨道表示式为  | |
| D. | 基态N原子的轨道表示式为  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.
醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 | |
| B. | 等物质的量的O2和O3中所含的氧原子数相同 | |
| C. | 等质量的CO与CO2中所含碳原子数之比为11:7 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 |  |  |  | 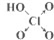 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有水参加的有机化学反应都可以叫做水解反应 | |
| B. | 丙烯、氯乙烯、苯分子内所有原子均在同一平面 | |
| C. | 棉花和木材在主要成分是纤维素,羊毛和蚕丝的主要成分是蛋白质 | |
| D. | 蔗糖是分布最广的二糖,一分子蔗糖能水解为两分子葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com