
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①②③④ |
分析 ①活泼的金属易与水反应,不能作电极;
②根据原电池的构成条件分析;
③原电池是将化学能转化为电能的装置;
④以铁、铜为电极,在稀硫酸溶液中构成原电池,负极反应式为Fe-2e-═Fe2+.
解答 解:①活泼的金属易与水反应,不能作电极,故错误;
③原电池的构成条件①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,若有活泼性不同的两种金属电极、有电解质溶液、导线,如果不能自发发生氧化还原反应,则不能形成原电池,故错误;
③原电池反应中能自发的进行氧化还原反应,是将化学能转化为电能的装置,故正确;
④以铁、铜为电极,在稀硫酸溶液中构成原电池,负极反应式为Fe-2e-═Fe2+,故错误;
故选C.
点评 本题考查的内容是高考中的常见考点,属于基础性试题的考查,难度不大,明确原电池的工作原理、构成条件是答题的关键.


科目:高中化学 来源: 题型:解答题
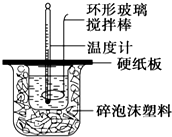 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Br2>Cl2>F2 | B. | 氧化性:Cl2>Br2>I2 | ||
| C. | 酸性:HClO4>HBrO4>HIO4 | D. | 稳定性:HI>HBr>HCl>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素全部是副族元素 | |
| B. | 周期表中的周期分为:短周期、长周期 | |
| C. | 周期表中的族分为:主族、副族、0族和VIII族 | |
| D. | 由短周期元素和长周期元素共同组成的族称为主族(除0族外) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲基所含有的电子数为10NA | |
| B. | 标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA | |
| C. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA | |
| D. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 必定是可溶性氯化物 | B. | 可能是可溶性碳酸盐 | ||
| C. | 可能含有Cl- | D. | 必定是氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
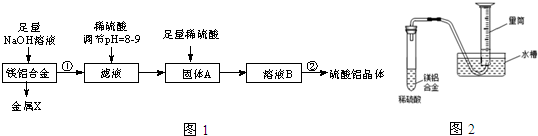
 ,固体A的化学式为Al(OH)3;
,固体A的化学式为Al(OH)3;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com