
【题目】下列指定反应的离子方程式表达正确的是( )
A. 少量Fe与稀硝酸反应:Fe+2H+=Fe2++H2↑
B. Ca(OH)2溶液中加入足量NaHCO3溶液:Ca2++HCO3-+ OH-=CaCO3↓+H2O
C. 氯气溶于水:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D. 铝片溶于NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
【答案】D
【解析】
A. 少量Fe与稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O,选项A错误;
B. Ca(OH)2溶液中加入足量NaHCO3溶液,反应生成碳酸钠、碳酸钙和水,反应的离子方程式为:Ca2++2HCO3-+ 2OH-=CaCO3↓+CO32-+H2O,选项B错误;
C. 氯气溶于水,反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O![]() H++Cl-+HClO,选项C错误;
H++Cl-+HClO,选项C错误;
D. 铝片溶于NaOH溶液中,反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,选项D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】(加试题)
(一)以一氯代乙酸钠(CH2ClCOONa)水溶液为原料,通过电解法可以制备1,2-二氯乙烷(CH2ClCH2Cl),装置如图1所示。
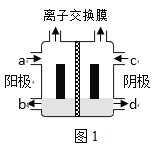
(1)所用的离子交换膜是___(填“阳”或“阴”)离子交换膜。
(2)写出电解池总反应___。
(二)1940年,我国著名化工专家侯德榜先生成功冲破了“索尔维”法的技术封锁,并加以改进,用NaCl固体代替生石灰,加入母液,并联合合成氨厂一起生产出纯碱和氯化铵。这便是举世闻名的“侯氏联合制碱法”,工艺流程如图2。
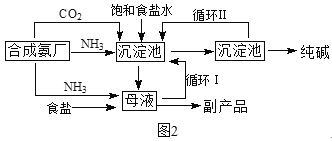
请回答:
(1)关于合成氨反应,下列说法合理的是___。
A.反应体系中一般用V2O5作催化剂
B.因为该反应ΔS小于零,所以反应的ΔH一定也小于零
C.因为该反应的ΔS小于零,所以反应的压强控制越高越好
D.该反应往往控制在500℃左右,是因为该温度下反应物转化率最高
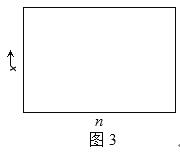
(2)一定温度下合成氨反应的平衡常数K=48。若在该温度下,在9L的恒容容器中投入1mol氮气和3mol氢气进行反应,则氨气的平衡产率y=___;若氮气和氢气的物质的量之比为n∶1,相应平衡体系中氨气的物质的量分数为x,请在图3中绘制x随n变化的示意图(计算时不计副反应)。______
(3)侯氏制碱法最大的优点是使原料氯化钠的利用率从70%提高到90%以上,主要是设计了____(填上述编号)的循环。
(4)关于侯氏联合制碱法,下列说法合理的是_____。
A.往沉淀池中先通入CO2再通入氨气的目的是提高NaHCO3的产量
B.往母液中加入食盐的目的是使NaHCO3更多地析出
C.从母液中经过循环Ⅰ进入沉淀池的主要是Na2CO3、NH4Cl和氨水
D.往母液中通氨气目的仅仅是增大NH4+的浓度,使NH4Cl更多地析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中央电视台报道联华超市在售的某品牌鸡蛋为“橡皮弹”,专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致。其结构简式如图:下列说法不正确的是( )
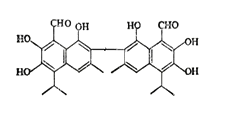
A. 该化合物的分子式为:C30H30O8
B. 1mol棉酚最多可与10mol H2加成,与6molNaOH反应
C. 在一定条件下,可与乙酸反应生成酯类物质
D. 该物质可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
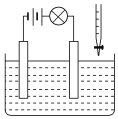
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中逐滴加入稀盐酸
D.硫酸中逐滴加入氢氧化钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修5:有机化学基础]
氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
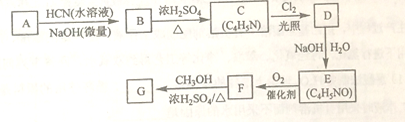
已知:
①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②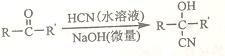
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为___________。
(5)G中的官能团有___、 ____ 、_____。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_____________
(2)W与Y 可形成化合物W2Y,该化合物的电子式为________________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_________________________。Y的最高价氧化物是否满足8电子稳定结构______________(填是.否)
(4)比较Y、Z气态氢化物的稳定性由大到小的顺序是________________(用分子式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是
____________________________________________________。(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.08mol气体;
第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
(已知, ![]() +OH-
+OH-![]() H2O+NH3↑)
H2O+NH3↑)
根据上述实验,回答以下问题。
(1)由第一份进行的实验推断该混合物是否一定含有Cl-?____________(答是或否)。
(2)由第二份进行的实验得知混合物中应含有____________(填离子符号),其物质的量浓度为____________。
(3)由第三份进行的实验可知12.54g沉淀的成分为____________。
(4)综合上述实验,你认为以下结论正确的是(______)
A.该混合液中一定含有K+、![]() 、
、![]() 、
、![]() ,可能含Cl-,且n(K+)≥0.04mol
,可能含Cl-,且n(K+)≥0.04mol
B.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含K+、Cl-
,可能含K+、Cl-
C.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
D.该混合液中一定含有![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用它。
(1)工业上通常采用电解法制氯气,请观察图后回答下列问题:

① 请写出该反应的化学方程式________________________________。
② 通电后,b侧产生的气体是______![]() 填化学式
填化学式![]() 。
。
(2)某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉![]() 这是一个放热反应
这是一个放热反应![]() ,回答下列问题:
,回答下列问题:

①在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,请写出反应的化学方程式________________________________。
②漂白粉将在U形管中产生,其化学方程式是______________________________。
③装置C的作用是______________。
④此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
I.温度较高时氯气与消石灰反应生成![]() ,为避免此副反应的发生,可采取的措施是________________________。
,为避免此副反应的发生,可采取的措施是________________________。
II.试判断另一个副反应![]() 用化学方程式表示
用化学方程式表示![]() ______________________________,为避免此副反应的发生,可以在A与B之间连接一个装有______的洗气瓶。
______________________________,为避免此副反应的发生,可以在A与B之间连接一个装有______的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】这次中美贸易战的矛盾激化,也让我们看到了中国半导体产业存在的诸多不足,俗话说“亡羊补牢,为时未晚”,找出存在的不足,然后针对地去解决问题,才能让半导体产业链发展壮大起来。三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室模拟反应![]() 制备POCl3并测定产品含量。
制备POCl3并测定产品含量。
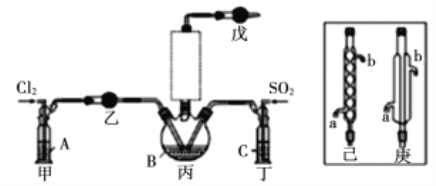
资料卡片:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -93.6 | 76.1 | 137.5 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于PCl3 |
SOCl2 | -105 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |
(1)若选用Na2SO3固体与70%浓H2SO4制取SO2,反应的离子方程式是:______________。
(2)溶液A为饱和食盐水,乙装置中应该盛装的试剂为__________(填“P2O5”或“碱石灰”或“浓H2SO4”或“无水硫酸铜”);反应装置图的虚框中未画出的仪器最好选择______(填“己”或“庚”)。
(3)甲、丁装置的作用除了用于气体的净化除杂外,还有_____________________________。
(4)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是_________________________。
(5)产品经提纯后仍含少量PCl3杂质,通过佛尔哈德法可测定产品中POCl3的含量:准确称取1.500g样品在碘量瓶中摇动至完全水解,将水解液配成100 mL溶液,取10.00 mL于锥形瓶中,加入0.2000 mol·L-1的AgNO3溶液20.00mL(Ag++C1-=AgC1↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000mol·L-1KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①达到滴定终点的现象是_____________________________________________________。
②POCl3的质量分数为________________________。
③已知:KSP(AgC1)=3.2×10-10 mol2·L-2,KSP(AgSCN)=2×10-12 mol2·L-2,若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将___________(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com