
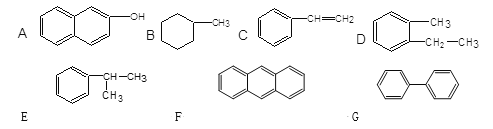
【题目】(1)下列物质中,属于芳香族化合物的是 ,属于芳香烃的是 ,属于苯的同系物的是 。(填编号)
(2)已知芳香烃A是煤焦油分馏出的一种组分。A不与溴水反应,但能使高锰酸钾酸性溶液褪色。1 mol A在镍催化剂的作用下,可与3 mol H2发生加成反应。0.5 mol A完全燃烧,生成3.5 mol CO2和2 mol H2O。通过计算推断A的名称是 。写出A与浓硝酸、浓硫酸混合酸在100℃时反应的化学方程式:_________________________。
【答案】(1)ACDEFG;CDEFG;DE
(2)甲苯
【解析】试题分析:(1)含有苯环的化合物属于芳香族化合物,则属于芳香族化合物的是ACDEFG;含有苯环的碳氢化合物属于芳香烃,则属于芳香烃的是CDEFG;苯上的氢原子被烷烃基取代所得到化合物是苯的同系物,则属于苯的同系物的是DE。
(2)已知芳香烃A是煤焦油分馏出的一种组分。A不与溴水反应,但能使高锰酸钾酸性溶液褪色。1 mol A在镍催化剂的作用下,可与3 mol H2发生加成反应,说明含有1个苯环。0.5 mol A完全燃烧,生成3.5 mol CO2和2 mol H2O,因此分子中碳氢原子的个数分别是3.5mol÷0.5mol=7、4mol÷0.8mol=8,即分子式为C7H8,名称是甲苯,与浓硝酸、浓硫酸混合酸在100℃时反应的化学方程式为 。
。


科目:高中化学 来源: 题型:
【题目】在15 mL0.10 mol·L-1NaOH 溶液中逐滴加入 0.20 mol·L-1 的氢氰酸(HCN,一元弱酸)溶液,溶液的pH和加入的氢氰酸溶液的体积关系曲线如下图所示,有关粒子浓度大小关系正确的是

A. 在 A、B 间任意一点:c(Na+)﹥c(CN-)﹥c(OH-)﹥c(H+)
B. 在 B 点:c(Na+) = c(CN-)﹥c( OH-) = c(H+),且 a=7.5
C. 在 C 点:c(CN-)﹥c(Na+)﹥c(OH-)﹥c(H+)
D. 在 D 点:c(HCN) + c(CN-)﹥2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.欲提高氯水中HClO的浓度可往氯水加适量的碳酸钙粉末
B.形成酸雨的氧化物主要是SO2和氮的氧化物,CO2是造成温室效应的主要气体
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.大气中的N2可转化为NO,NO可转化为NO2、硝酸等;含硫物质在自然界中可转化为SO2等含硫化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、 Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式____________。
(2)TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4-中B原子的杂化类型为____________;
(3)在 TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子化学式为_________________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色),两者配位数_____(填“相同”或“不同”),绿色晶体中配体是______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为____________。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为![]() g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的化学方程式为_________________。
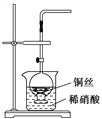
图甲
(2)NO是有毒气体。某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁 B.铝
C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是________________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
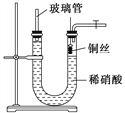
图乙
①长玻璃管的作用是______________________________________________。
②让反应停止的操作方法及原因是________________________________。
以下收集NO气体的装置,合理的是________(填选项代号)。
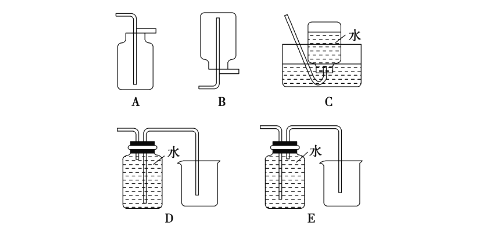
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知Li2Ti5O15和Na2O2中都含有过氧键,Ti的化合价为+4,Na2O2中含有一个过氧键,则Li2Ti5O15中过氧键的数目为
A. 2 个 B. 4 个 C. 6 个 D. 8 个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中加入4molA、1.2molC和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂。
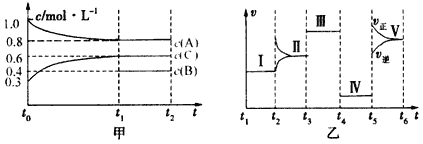
(1)若t1=15s,则t0~t1阶段的反应速率为v(C)= 。
(2)t4时刻改变的条件为 。
(3)已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q 为正值),试写出该反应的热化学方程式:__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应 3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2NO↑+ 4H2O,以下叙述正确的是( )
A. 氧化剂和还原剂的物质的量比为8: 3
B. 被还原的HNO3和起酸性作用的HNO3的物质的量的比为2∶3
C. 该反应的电子转移数为6e-
D. 该反应中Cu(NO3)2 为氧化产物,H2O为还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家冶炼出了纯度高达 99.999%的铁,估计它不会具有的性质是( )
A. 硬度比生铁低
B. 在潮湿的空气中放置不易生锈
C. 与 4mol/L 盐酸的反应速率比生铁快
D. 在冷的浓硫酸中可以钝化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com