
| A. | H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0 | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H<0 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H<0 | |
| D. | 3Cu(s)+8HNO3(aq)═3Cu(NO3)2(aq)+2NO(g)+4H2O(l)△H<0 |
科目:高中化学 来源: 题型:选择题
| A. | 偏铝酸钠溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 氧化铝溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O | |
| C. | 石灰水中加入少量小苏打:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物中一定没有非极性键 | |
| B. | 单质中不可能含有离子键 | |
| C. | 金属元素与非金属元素间形成的键均是离子键 | |
| D. | CO2、CH4分子中每个原子最外层均形成了8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
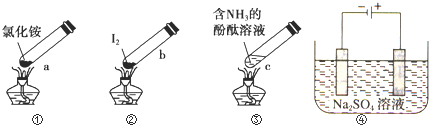
| A. | 加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| B. | 加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 | |
| C. | 加热时,c中溶液红色变深,冷却后又变浅 | |
| D. | ④左侧为e右侧为f,在惰性电极e和f附近分别滴加紫色石蕊试液,e电极附近呈红色,f电极附近呈蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
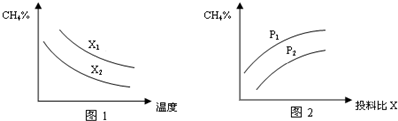
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、Cu、Ag、Al、Mg | B. | Mg、Cu、Al、Ag、Fe | C. | Al、Cu、Ag、Mg、Fe | D. | Mg、Ag、Cu、Al、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
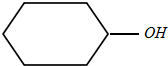 ),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )
),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )| A. | 68 | B. | 75 | C. | 80 | D. | 87.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z |
| W |
| A. | W位于第三周期ⅥA族 | |
| B. | 元素最高正价:Z>Y>X | |
| C. | 简单气态氢化物稳定性:W>Y>X | |
| D. | 工业上催化氧化Y的氢化物可用于制备其含氧酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com