
分析 (1)铁锅未及时洗净(残液中含NaCl)能发生电化学腐蚀;
(2)钢铁的吸氧腐蚀,负极Fe失电子生成亚铁离子,正极上为氧气得电子生成氢氧根离子;吸氧腐蚀生成氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁;
(3)根据电化学原理在金属设备上采取措施,使之成为原电池中的负极.
解答 解:(1)铁锅未及时洗净(残液中含NaCl)能发生电化学腐蚀,由于电解质溶液为中性所以发生吸氧腐蚀;
故答案为:吸氧;
(2)钢铁的吸氧腐蚀,负极Fe失电子生成亚铁离子,发生的反应为:Fe-2e-=Fe2+,正极上为氧气得电子生成氢氧根离子,其电极反应式为:2H2O+O2+4e-=4OH-,吸氧腐蚀生成氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁,则发生的反应为Fe2++2OH-═Fe(OH)2 ,4Fe(OH)2 +2H2O+O2═4Fe(OH)3;
故答案为:Fe-2e-=Fe2+;2H2O+O2+4e-=4OH-;Fe2++2OH-═Fe(OH)2 ,4Fe(OH)2 +2H2O+O2═4Fe(OH)3;
(3)大型水库的钢闸门的防锈就是在铁上加比铁活泼的金属,利用的防止锈蚀的原理是:构成原电池,负极比铁活泼的金属溶解保护正极铁,
故答案为:焊接上比铁更活泼的金属,如锌.
点评 本题考查了金属的防锈措施,根据铁生锈的条件进行分析,铁在有水和氧气并存时易生锈,防锈就是使铁与水或氧气隔绝,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1×10-2mol/L | B. | 1×10-7mol/L | C. | 1×10-12mol/L | D. | 1×10-14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
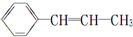 ,下列关于该烃的说法错误的是( )
,下列关于该烃的说法错误的是( )| A. | 该烃易溶于有机溶剂,但不易溶于水 | |
| B. | 1 mol该烃含有1 mol碳碳双键 | |
| C. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| D. | 能发生聚合反应,其产物可表示为: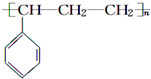 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ②④ | C. | ①③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 10种 | C. | 11种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 范德华力、范德华力、离子键 | B. | 范德华力、共价键、共价键 | ||
| C. | 范德华力、范德华力、共价键 | D. | 共价键、共价键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
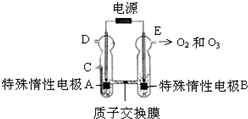 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.pH t/min T/℃ | 3,.0 | 4,.0 | 5,.0 | 6,.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定量的Ba(OH)2溶液中通入过量SO2气体SO2+OH-═HS${{O}_{3}}^{-}$ | |
| B. | 4 mol•L-1的NaAlO2溶液和7 mol•L-1的盐酸等体积混合4 Al${O}_{2}^{-}$+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 在碳酸氢钠溶液中加入等物质的量的氢氧化钙溶液Ca2++HC${O}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| D. | 用惰性电极电解氯化铝溶液2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com