
 几种有机物的转化关系如图所示:已知流程中W、X、Z都不能与新制氢氧化铜悬浊液反应生成红色固体.X、Y重新组合生成的酯有( )
几种有机物的转化关系如图所示:已知流程中W、X、Z都不能与新制氢氧化铜悬浊液反应生成红色固体.X、Y重新组合生成的酯有( )| A. | 2种 | B. | 4种 | C. | 6种 | D. | 12种 |
分析 分子式为C6H12O2的有机物在酸性条件下可水解为酸和醇,酸有甲酸、乙酸、丙酸、丁酸和戊酸,醇有甲醇、乙醇、丙醇、丁醇、戊醇,但生成的醇可以被氧化为醛类,然后根据醇的同分异构体结合得到的酸X来确定酯的同分异构体种类.
解答 解:分子式为C6H12O2的有机物在酸性条件下可水解为酸和醇,酸有甲酸、乙酸、丙酸、丁酸和戊酸,醇有甲醇、乙醇、丙醇、丁醇、戊醇,但生成的醇可以被氧化为醛类,则醇X和酸Y的组合可以是:甲醇和戊酸(4种),乙醇和丁酸(2种),1-丙醇和丙酸,1-丁醇和乙酸,2-甲基-1-丁醇和乙酸,1-戊醇和甲酸,2-甲基-1-丁醇和甲酸,3-甲基-1-丁醇和甲酸,X、Y重新组合生成的酯有12种.
故选D.
点评 本题考查同分异构体的书写与判断,难度中等,关键确定醇的结构及羧酸的同分异构体,注意利用数学法进行计算.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:实验题
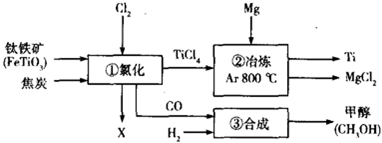
 .
.
查看答案和解析>>
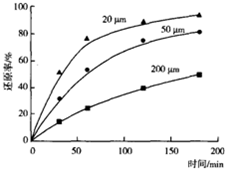
科目:高中化学 来源: 题型:选择题
| A. | 反应速率主要取决于反应②的快慢 | B. | 反应速率v(NO)=v(NOBr)=2v(Br2) | ||
| C. | NOBr2是该反应的催化剂 | D. | 该反应的焓变等于akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023是阿伏加德罗常数的近似值 | |
| B. | 阿伏加德常数个微粒的物质的量是1 mol | |
| C. | 1 mol 12C原子的质量为12 g | |
| D. | 硫酸的摩尔质量是98 g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
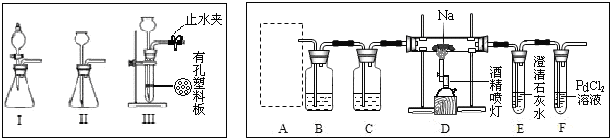
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
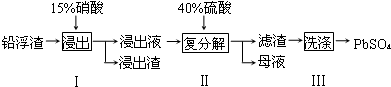
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
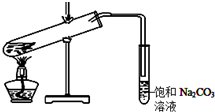 某学生做乙酸乙酯的制备实验装置如图所示.
某学生做乙酸乙酯的制备实验装置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com