
| A. | 晶体根据结构和性质只可分为分子晶体,原子晶体,离子晶体和金属晶体四大类 | |
| B. | 含有阳离子的晶体一定是离子晶体,且离子晶体中可能含有共价键 | |
| C. | 任何晶体中部分含有化学键,如离子键、共价键、金属键、氢键等 | |
| D. | 原子晶体的熔沸点不一定高于离子晶体,而离子晶体的熔沸点肯定高于分子晶体 |
分析 A.根据晶体的构成微粒将晶体分为四类;
B.含有阳离子的晶体不一定是离子晶体,离子晶体中一定含有离子键,可能含有共价键;
C.单原子分子中不含化学键;
D.原子晶体的熔沸点不一定高于离子晶体,如MgO的熔点为2852℃,而SiO2的熔点为1710℃;而离子晶体的熔沸点较高、分子晶体熔沸点较低.
解答 解:A.根据晶体的构成微粒将晶体分为分子晶体、原子晶体、离子晶体和金属晶体四类,故A错误;
B.含有阳离子的晶体不一定是离子晶体,如金属晶体;离子晶体中一定含有离子键,可能含有共价键,如KOH,故B错误;
C.单原子分子中不含化学键,且氢键是分子间作用力而不是化学键,故C错误;
D.原子晶体的熔沸点不一定高于离子晶体,如MgO的熔点为2852℃,而SiO2的熔点为1710℃;而离子晶体的熔沸点较高、分子晶体熔沸点较低,所以离子晶体的熔沸点肯定高于分子晶体,故D正确;
故选D.
点评 本题考查化学键与晶体及晶体熔沸点之间关系,侧重考查分析判断能力,知道常见晶体类型及分类方法,易错选项是C,注意稀有气体中不含化学键,注意氢键属于分子间作用力,配位键属于共价键,为易错点.


科目:高中化学 来源: 题型:解答题
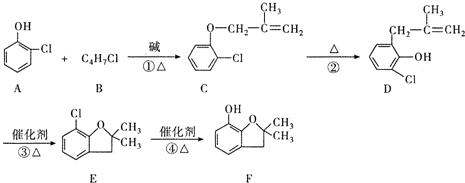
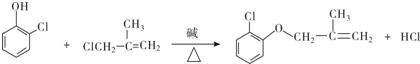 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).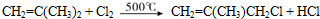
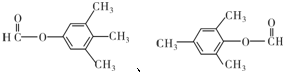
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: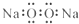 | |
| B. | 硫离子的结构示意图: | |
| C. | NH4Cl的电子式: | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务.下列举措不符合这一要求的是( )
节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务.下列举措不符合这一要求的是( )| A. | 倡导开私家车的人乘公交车上下班 | |
| B. | 用节能灯代替白炽灯 | |
| C. | 政府鼓励科研和生产部门开发、利用太阳能 | |
| D. | 加快开发石油以缓解能源紧张问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子有得失 | B. | 共用电子对有偏移 | ||
| C. | 电子既有得失又有偏移 | D. | 金属元素的存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com