
| A. | 二氧化碳与石灰水:CO2+OH-=HCO3- | |
| B. | 氯化铁和硫氢化钠:2Fe3++2HS-=Fe2++2H++FeS↓+S↓ | |
| C. | 硫酸亚铁铵和氢氧化钡:2NH4++2OH-+Ba2++SO42-=2NH3•H2O+BaSO4↓ | |
| D. | 在酸性条件下亚硫酸钠和硫化钠:2SO32-+2S2-+8H+=3S↓+SO2↑+4H2O |
分析 A.反应生成碳酸钙和水;
B.发生氧化还原反应,遵循电子、电荷守恒;
C.碱不足,反应生成硫酸钡、氢氧化亚铁;
D.发生氧化还原反应生成S和水,过量亚硫酸根离子与酸反应.
解答 解:A.二氧化碳与石灰水1:1反应的离子反应为CO2+Ca2++OH-=H2O+CaCO3↓,故A错误;
B.氯化铁和硫氢化钠的离子反应为2Fe3++2HS-=Fe2++2H++FeS↓+S↓,故B正确;
C.硫酸亚铁铵和氢氧化钡1:1反应的离子反应为Fe2++2OH-+Ba2++SO42-=Fe(OH)2↓+BaSO4↓,故C错误;
D.在酸性条件下亚硫酸钠和硫化钠的离子反应为2SO32-+2S2-+8H+=3S↓+SO2↑+4H2O,故D正确;
故选BD.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意氧化还原反应及离子反应中保留化学式的物质,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
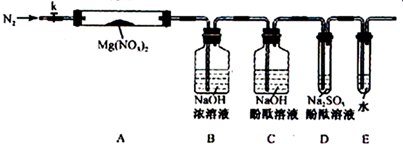
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
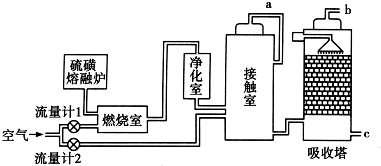
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
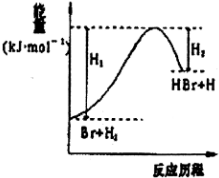
| A. | 该反应为可逆反应 | B. | 加入催化剂,可提高HBr的产率 | ||
| C. | 反应物总能量低于生成物总能量 | D. | 反应物总键能低于生成物总键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
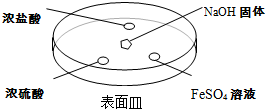
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 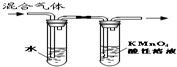 装置可用于检验溴乙烷消去反应的产物 | |
| B. | 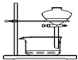 装置可用于放出碘的四氯化碳溶液 | |
| C. | 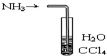 装置可用于吸收NH3防止倒吸 | |
| D. | 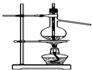 装置可用于实验室制备蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
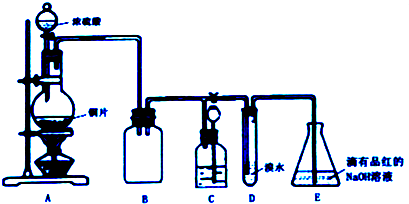
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
| ② | 滴加少量棕红色的KI3溶液,振荡 | II | |
| ③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
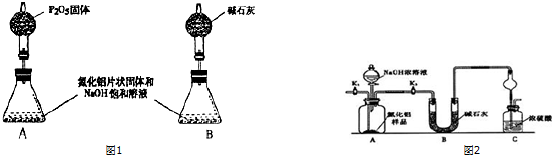
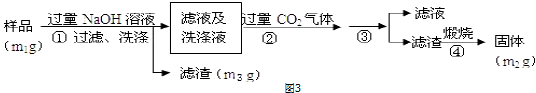
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com