
| 弱酸 | H2CO3 | 水杨酸(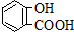 ) ) |
| 电离平衡常数(925℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常温下,等浓度、等体积的NaHCO3溶液pH小于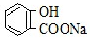 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2CO3溶液和  溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→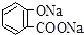 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1的原因之一是能形成分子内氢键 |
分析 A.相同温度下,酸根离子水解程度越大,其相同浓度的钠盐溶液pH越大;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得 c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)、c(Na+)+c(H+)=c(OH-)+c(C7H5O2-)+2c(C7H4O32-),碳酸的二级电离平衡常数大于水杨酸二级电离平衡常数,所以水解程度CO32-<C7H4O32-,则 溶液碱性强,所以c(H+):Na2CO3溶液>
溶液碱性强,所以c(H+):Na2CO3溶液> 溶液;
溶液;
C.水杨酸二级电离平衡常数小于碳酸,所以酚羟基和碳酸氢根离子不反应,羧基和碳酸氢根离子反应;
D.水杨酸中-OH中的H原子和羧酸根离子中的O原子能形成氢键.
解答 解:A.相同温度下,酸根离子水解程度越大,其相同浓度的钠盐溶液pH越大,水解程度HCO3->C7H5O2-,所以常温下,等浓度、等体积的NaHCO3溶液pH大于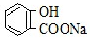 溶液pH,故A错误;
溶液pH,故A错误;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得 c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)、c(Na+)+c(H+)=c(OH-)+c(C7H5O2-)+2c(C7H4O32-),碳酸的二级电离平衡常数大于水杨酸二级电离平衡常数,所以水解程度CO32-<C7H4O32-,则 溶液碱性强,所以c(H+):Na2CO3溶液>
溶液碱性强,所以c(H+):Na2CO3溶液> 溶液,两种溶液中钠离子浓度相等,所以常温下,等浓度、等体积的Na2CO3溶液和
溶液,两种溶液中钠离子浓度相等,所以常温下,等浓度、等体积的Na2CO3溶液和  溶液中所含离子总数前者大于后者,故B错误;
溶液中所含离子总数前者大于后者,故B错误;
C.水杨酸二级电离平衡常数小于碳酸,所以酚羟基和碳酸氢根离子不反应,羧基和碳酸氢根离子反应,反应方程式为 +NaHCO3→
+NaHCO3→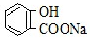 +H2O+CO2↑,故C错误;
+H2O+CO2↑,故C错误;
D.-OH中O原子吸引电子能力较强,所以水杨酸中-OH中的H原子和羧酸根离子中的O原子能形成氢键,导致水杨酸的第二级电离 Ka2 远小于第一级电离Ka1,故D正确;
故选D.
点评 本题考查弱电解质的电离,明确弱电解质电离平衡常数与其酸根离子水解程度关系是解本题关键,易错选项是BC,注意B中离子浓度比较方法,利用电荷守恒分析,注意C中酚羟基和碳酸氢钠不反应.


科目:高中化学 来源: 题型:选择题
| A. | 小于0 | B. | 等于0 | C. | 大于0 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 |  | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | B. | 二溴乙烷和水,溴苯和水,酒精和水 | ||
| C. | 甘油和水,乙醛和水,乙酸和乙醇 | D. | 苯和水,甲苯和水,己烷和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=y=z | B. | x>y=z | C. | x<y=z | D. | x=y<z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数和电子数相等的微粒一定是原子 | |
| B. | 两种微粒如果核外电子排布相同,化学性质就一定相同 | |
| C. | 质量数相同的原子其化学性质一定相同 | |
| D. | 具有相同核电荷数的原子或单核离子一定是同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
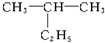 命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.
命名为“2-乙基丙烷”,错误原因是主链选错;将其命名“3-甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.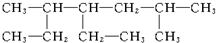 的名称为2,5-二甲基-4-乙基庚烷.
的名称为2,5-二甲基-4-乙基庚烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为吸热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中含δ键又含π键 | D. | 每生成1.8gH2O消耗2.24LO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com