
分析 (1)①利用三段式求出2min平衡时氢气的物质的量,体积变为2L,则浓度为原来的一半,再根据平衡转化率求出第二次平衡时氢气的浓度;
②催化剂能增大反应速率;
(2)①NaClO溶液和NH3发生氧化还原反应生成氯化钠和肼,根据反应物和生成物写出反应方程式;
②电离方程式为N2H4+H2O?N2H5++OH-,根据K=$\frac{c({N}_{2}{{H}_{5}}^{+})×c(O{H}^{-})}{c({N}_{2}{H}_{4})}$计算;
③依据盖斯定律,结合题干中已知热化学方程式计算N2H4(l)+O2(g)=N2(g)+2H2O(l)的反应热;
(3)2N2O4+2H2O+O2=4HNO3,反应中N2O4/H2O的质量比等于5.11,高于5.11,则提高了N2O4的浓度,根据浓度对化学平衡移动的影响分析.
解答 解:(1)①0.6mo1氮气和1.8mo1氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,2min后达到平衡,氮气的物质的量为0.3mo1
N2(g)+3H2(g)=2NH3(g)
起始(mol):0.6 1.8 0
转化(mol):0.3 0.9 0.6
平衡(mol):0.3 0.9 0.6
在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,则此时c(H2)=$\frac{0.9mol}{2L}$=0.45mol/L;
体系达到平衡时N2的总转化率为38.2%,则转化的氮气为0.6mol×38.2%=0.2292mol;
N2(g)+3H2(g)=2NH3(g)
起始(mol):0.6 1.8 0
转化(mol):0.23 0.69 0.46
平衡(mol):0.37 1.11 0.46
所以第二次平衡时c(H2)=$\frac{1.11mol}{2L}$=0.555mol/L,
则第25min起H2的物质的量浓度为0.45mol/L,平衡时为0.555mol/L,所以图象为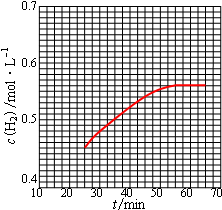 ;
;
故答案为: ;
;
②催化剂能增大反应速率,所以该反应体系未达到平衡时,催化剂对逆反应速率的影响是增大;
故答案为:增大;
(2)①该反应中,次氯酸钠被氨气含有生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O;
故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
②电离方程式为N2H4+H2O?N2H5++OH-,室温下其电离常数K1≈1.0×10-6,则0.01mol•L-1N2H4水溶液中c(N2H5+)≈c(OH-),
K=$\frac{c({N}_{2}{{H}_{5}}^{+})×c(O{H}^{-})}{c({N}_{2}{H}_{4})}$=$\frac{{c}^{2}(O{H}^{-})}{0.01}$=1.0×10-6,所以c(OH-)=10-4mol/L,则c(H+)=10-10mol/L,则溶液的pH=10;
故答案为:10;
③已知:N2(g)+3H2(g)=2NH3(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
2H2(g)+O2(g)=2H2O(g)△H3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(l)△H4
由盖斯定律可知,N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=$\frac{3}{2}$△H2-△H1-$\frac{1}{2}$△H4;
故答案为:$\frac{3}{2}$△H2-△H1-$\frac{1}{2}$△H4;
(3)由NO2转化为HNO3的工艺图可知,N2O4与水、氧气反应生成硝酸,2N2O4+2H2O+O2=4HNO3,反应中N2O4/H2O的质量比等于5.11,当高于5.11,则提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸;
故答案为:2N2O4+2H2O+O2=4HNO3,中N2O4/H2O的质量比等于5.11,高于5.11是为了提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸.
最后一问少了流程图,请填上谢谢,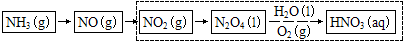
点评 本题考查了化学平衡的有关计算、电离常数及其计算、盖斯定律的应用、工艺流程图的分析应用等,题目难度中等,侧重于考查学生对基础知识的综合应用能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol溴苯中含有双键的数目为0.3NA | |
| B. | 1L 0.1 mol/L醋酸溶液中含有醋酸分子的数目为0.1 NA | |
| C. | 常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| D. | 常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mn2++CO2↑+8H2O.
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mn2++CO2↑+8H2O.| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol•L-1 KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
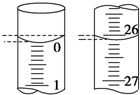
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 2 8.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | NaCl |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 801 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
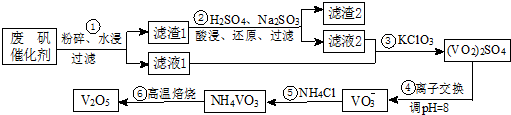
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
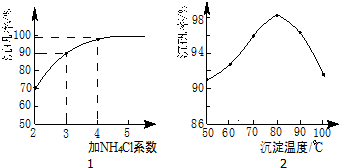
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 说法 | 解释 |
| A | 加热条件下,浓硝酸与碳粉的反应可在铁制容器中进行 | 铁能被浓硝酸钝化 |
| B | 浓氨水可用于检验氯气管道泄露 | 过量的NH3与Cl2反应有白烟产生 |
| C | 用惰性电极电解MgCl2溶液可冶炼Mg | Mg2+在阴极得电子生成Mg |
| D | 葡萄糖和油脂均为人体所需能量的重要来源 | 二者在体内水解的产物被氧化可提供能量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
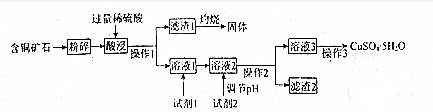
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.0 | 6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
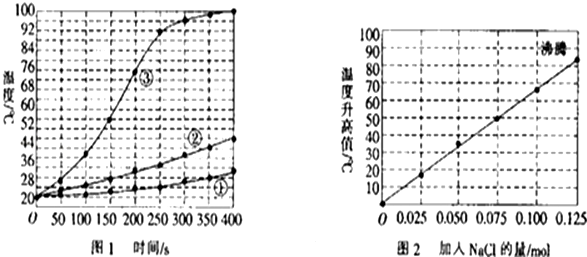
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入到BaCl2溶液中:Ba2++SO2+H2O=BaSO3↓+2H+ | |
| B. | 浓H2SO4与硫化亚铁制取H2S气体:H2SO4+FeS=Fe2++SO42-+H2S↑ | |
| C. | SO2使溴水褪色:SO2+2H2O+Br2=4H++SO42-+2Br- | |
| D. | 氯化铵固体与熟石灰共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com