
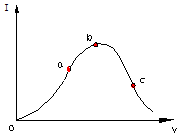
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:分析 (1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强;
(2)导电能力越强,离子浓度越大,氢离子浓度越大;
(3)越稀越电离,水的量越大醋酸电离度越大;
(4)使c(CH3COO-)增大,则使醋酸的电离平衡正移,或增加醋酸根的量;
(5)电离时含有相同的离子能抑制酸电离.
解答 解:(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,所以冰醋酸不导电,
故答案为:在“O”点处醋酸未电离,无离子存在;
(2)由于导电能力越强,溶液中离子浓度越大,氢离子浓度越大,
故答案为:c<a<b;
(3)越稀越电离,水的量越大醋酸电离度越大,所以电离程度最大的是c,故答案为:c;
(4)A.加盐酸,氢离子浓度增大,醋酸的电离平衡逆移,c(CH3COO-)减小,故A错误;
B.加浓醋酸溶液中离子浓度增大,醋酸根离子浓度相应增大,故B正确;
C.加入固体KOH,消耗氢离子,则醋酸的电离平衡正移,c(CH3COO-)增大,故C正确;
D.加水稀释,促进醋酸的电离,但是溶液体积增大程度大,c(CH3COO-)减小,故D错误;
E.加固体CH3COONa,c(CH3COO-)增大,故E正确;
F、加Zn粒,Zn与氢离子反应,氢离子浓度减小,则醋酸的电离平衡正移,c(CH3COO-)增大,故F正确;
故答案为:BCEF;
(5)硫酸溶液中,硫酸第一步电离出氢离子,第二步又电离出氢离子,第一步电离出的氢离子抑制了第二步的电离,而硫酸氢钠溶液中硫酸氢根离子只有一步电离,所以.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度,
故答案为:硫酸的第一步电离抑制了硫酸氢根离子的电离.
点评 本题考查了弱电解质的电离,题目难度不大,注意把握决定溶液导电性的因素、影响电离平衡的因素等知识点.


科目:高中化学 来源: 题型:选择题
| A. | 用NH4C1溶液溶解Mg(OH)2:Mg(OH)2+2NH4 +═Mg2十+2NH3•H2O | |
| B. | 用氨水除去NH4 C1溶液中的FeC13:Fe3++3OH-═Fe(OH)3 | |
| C. | Na2S水解:S2-+2H2O?H2S+2OH- | |
| D. | 用H2S气体作为沉淀剂除去溶液中的Cu2+:Cu2++S2-═CuS↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8 mol/L | B. | 9 mol/L | C. | 11 mol/L | D. | 12 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H、2H、3H互为同素异形体 | |
| B. | CO2的比例模型: | |
| C. | NaHCO3在水溶液中的电离方程式:NaHCO3?Na++HCO3-HCO3-?H++CO32- | |
| D. | 次氯酸的电子式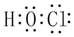 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K越大,达到平衡时,反应进行的越完全 | |
| B. | K随反应物浓度的改变而改变 | |
| C. | K越小,达到平衡时,反应物的转化率越大 | |
| D. | K不随温度的升高而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 由乙烯生成乙醇属于加成反应 | |
| C. | C4H9Cl有3种同分异构体 | |
| D. | 光照条件下,甲烷通入氯水中,氯水黄绿色褪去,说明甲烷与氯水发生了取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2溶液蒸干灼烧后得到CuCl2固体 | |
| B. | 火力发电的目的是使化学能转换为电能 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,无法比较二者的稳定性. | |
| D. | 将FeCl3固体溶于适量蒸馏水来配制FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com