
(12分)某同学设计了如下图所示装置(部分夹持装置已略去)进行实验研究。
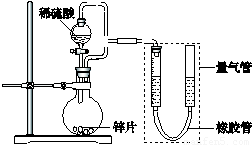
请回答:
(1)用上述装置探究影响化学反应速率的因素。
① 圆底烧瓶中发生反应的离子方程式是 。[来源:]
② 用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为t1>t2。
|
序号 |
V(H2SO4)/mL |
c(H2SO4)/mol·L-1 |
t/s |
|
Ⅰ |
40 |
1 |
t1 |
|
Ⅱ |
40 |
4 |
t2 |
比较实验Ⅰ和Ⅱ可以得出的实验结论是 。
实验过程中,对量气管的操作是 。
③ 若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是(填序号) 。
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
① 圆底烧瓶中的试剂可选用(填序号) 。
a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
② 能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是 。
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

请根据题意回答下列问题:
(1)实验步骤的顺序应为(填序号)____________。
(2)用a、b、c表示钠的相对原子质量为______________________________。
(3)下列因素对实验结果分别有何影响?(填“偏大”“偏小”或“无影响”)①没有B装置__________;②取用金属钠时未吸干煤油__________;③称得的金属钠表面变暗后才放入锥形瓶_______________;④反应时,钠燃烧起来________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
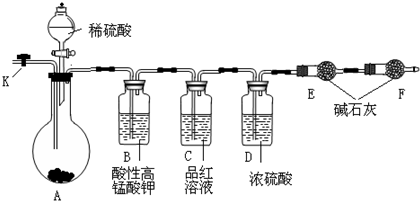
(17分)甲、乙、丙是中学中常见的单质,X、Y、Z是常见的化合物。在常温常压下,甲是具有氧化性的黄绿色气体,丙是棕红色的液体,Y与Z含有相同的阳离子,X与Z含有相同的阴离子;它们之间有以下转化关系:丙十乙
→Z;X十丙→Z;X+甲→Y+丙。请回答下列问题:
(1)写出甲、乙、丙三种物质的化学式___ _、 、___ _;
(2)写出X与足量的甲在溶液中完全反应时的离子方程式 。
(3)欲在实验室中制取并收集纯净、干燥的气体甲,然后完成上述反应“X+甲→Y+丙”,某同学设计了如下图所示的装置。
①装置A中发生反应的化学方程式为 ;
②装置B的作用是 ;
③装置C中的试剂为 ;
④装置D中收集气体甲的方法名称是 ;
⑤装置F的主要作用是 ,反应原理的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014届河南省平顶山市高二上学期期末考试化学试卷(解析版) 题型:填空题
某同学设计了如下图所示的装置进行电化学实验,请你根据装置图回答相关问题:
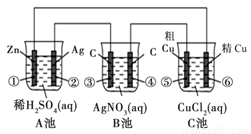
(1)C池属于什么装置 。
(2)电极②上发生电极反应式为 ;B池中发生的总反应方程式为 。
(3)反应进行一段时间后,A、B、C三池中电解质溶液浓度基本不变的是________。
(4)当电路上有0.2 mol电子流过时,电极④上质量变化______g, 电极⑥上质量变化______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com