
下列说法或表示方法正确的是 ( )
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
C.300℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| D.由C(石墨)=C(金刚石)△H=" +1.90" kJ·mol-1可知,金刚石比石墨稳定 |
B
解析试题分析:气态S的能量高于固态S的能量,所以等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,A不正确;醋酸是弱酸,溶于水存在电离平衡,而电离是吸热的,则将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ,选项B正确;选项C中的反应是可逆反应,则不能计算该反应的反应热,C不正确;选项D中石墨的总能量低于金刚石的总能量。能量越低越稳定,所以石墨比金刚石稳定性强,D不正确,答案选B。
考点:考查反应热、中和热的判断和计算即物质稳定性的判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题针对性强,难易适中,主要是考查学生对反应热、中和热判断和计算以及物质稳定性的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力。


科目:高中化学 来源: 题型:单选题
已知:S(s)+O2(g)→SO2(g) +297.16kJ,2SO2(g)+O2(g) 2SO3(g)+196.6 kJ,下列说法正确的是
2SO3(g)+196.6 kJ,下列说法正确的是
| A.1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和 |
| B.将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量 |
C.S(g)+O2(g) SO2(g)+Q,Q值小于297.16 kJ SO2(g)+Q,Q值小于297.16 kJ |
| D.当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,下列叙述正确的是( )
| A.2个氢分子和1个氧分子反应生成2个水分子,放出热量571.6 kJ |
| B.2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),吸收热量571.6 kJ |
| C.2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ |
| D.2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),放出热量571.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化: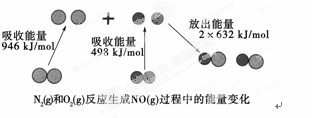
下列说法中正确的是( )
| A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
乙醇分子结构中各种化学键如下所示,关于乙醇在各种反应中断键的说明不正确的为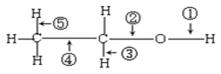
| A.和乙酸共热时,断裂①键 |
| B.和金属钠反应时,键①断裂 |
| C.和P2O5共热时,键②⑤断裂 |
| D.在铜催化下和氧气反应时,键①⑤断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可逆反应A+B(s)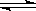 C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是( )
C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是( )
A. A为固体,C为气体,正反应为放热反应
B. A为气体,C为固体,正反应为放热反应
C. A为气体,C为固体,正反应为吸热反应
D. A、C均为气体,正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体(分子式为CH4·9H2O),则356g“可燃冰”释放出的甲烷燃烧,生成液态水时能放出1780.6 kJ的热量,则甲烷燃烧的热化学方程式可表示为:_______________________________。
(2) 在100℃时,将0.100mol的N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到下表数据: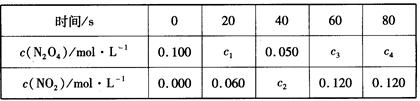
①从表中分析:该反应的平衡常数为___________;
②在上述条件下,60s内N2O4的平均反应速率为_____________;
③达平衡后下列条件的改变可使NO2浓度增大的是_________。
| A.增大容器的容积 | B.再充入一定量的N2O4 |
| C.再充入一定量的NO2 | D.再充入一定量的He |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)
用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)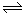 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
②CaSO4(s)+CO(g)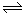 CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
③CO(g)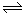 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
(1)反应2 CaSO4(s)+7CO(g)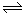 CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见图18.结合各反应的△H,归纳lgK~T曲线变化规律: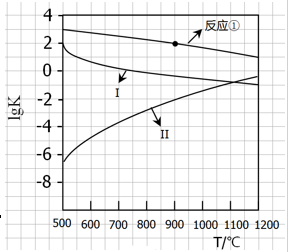
a)
b)
(3)向盛有CaSO4的真空恒容容器中充入CO,反应①于900 ºC达到平衡,c平衡(CO)=8.0×10-5mol·L-1,计算CO的转化率(忽略副反应,结果保留2位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入 。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生成CaSO4,该反应的化学方程式为 ;在一定条件下CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com