
| A. | 溶液中的OH-向正极移动 | |
| B. | 在银表面上的反应为:2Al+3Ag2S═6Ag+Al2S3 | |
| C. | 正极反应式为:Ag2S+2e-═2Ag+S2- | |
| D. | 在铝表面的反应为:Al+3OH--3e-═Al(OH)3 |
分析 将轻微腐蚀蒙有硫化银的银器和铝片一起接触浸泡在稀NaOH溶液中,可形成原电池反应,Al为负极,发生Al+4OH--3e-═[Al(OH)4]-,Ag极为正极,发生Ag2S+2e-═2Ag+S2-,以此解答该题.
解答 解:A.原电池中阴离子向负极移动,阳离子向正极移动,故A错误;
B.硫化银在银表面上发生还原反应生成银,方程式为Ag2S+2e-═2Ag+S2-,故B错误;
C.Ag2S被还原,为正极反应,电极方程式为Ag2S+2e-═2Ag+S2-,故C正确;
D.Al为负极,溶液呈碱性,发生Al+4OH--3e-═[Al(OH)4]-,故D错误.
故选C.
点评 本题考查原电池知识,为高考高频考点,侧重于基础知识的考查,难度不大,注意把握原电池的工作原理以及电极方程式的书写.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
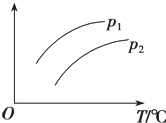 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g)△H>0;平衡移动关系如图所示.下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g)△H>0;平衡移动关系如图所示.下列说法正确的是( )| A. | p1<p2,纵坐标指A的体积分数 | |
| B. | p1>p2,纵坐标指C的质量分数 | |
| C. | p1<p2,纵坐标指A的转化率 | |
| D. | p1<p2,纵坐标指混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先滴加BaCl2溶液再滴加HCl溶液,生成白色沉淀,原溶液中有SO42- | |
| B. | 滴加氯水和CCl4,振荡、静置,上层溶液显紫色,原溶液中有I- | |
| C. | 用洁净铁丝蘸取溶液进行焰色反应,火焰呈黄色,原溶液中有Na+ | |
| D. | 滴加NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
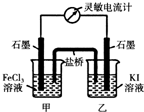 常温下,将FeCl3溶液和KI溶液混合,发生如下反应:2Fe3++2I-?2Fe2++I2
常温下,将FeCl3溶液和KI溶液混合,发生如下反应:2Fe3++2I-?2Fe2++I2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多数合金的硬度一般比其各成分金属的硬度高 | |
| B. | 多数合金的熔点一般比其各成分金属的熔点低 | |
| C. | 合金中可以含有非金属元素 | |
| D. | 合金的化学性质一般与其各成分金属的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
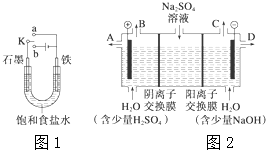 (1)某课外活动小组同学用图1装置进行实验,试回答下列问题:
(1)某课外活动小组同学用图1装置进行实验,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg、Al在空气中性质稳定,因而都具有很强的抗腐蚀性 | |
| B. | 质量数相等的不同核素,一定属于不同种元素 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 自行车钢架生锈主要是化学腐蚀所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.如图为该电池放电过程示意图,Cn为石墨烯,下列说法不正确的是( )
最近报道了一种新型可充电式铝电池.电解质为阳离子(EMl+)与阴离子(AlCl4-)组成的离子液体.如图为该电池放电过程示意图,Cn为石墨烯,下列说法不正确的是( )| A. | 充电时,每生成1mol Al,电解质溶液中会增加7molAlCl4- | |
| B. | 放电时,电解质中的阳离子(EMl+)未发生反应 | |
| C. | 放电时,负极反应方程式为Al+7AlCl4--3e-═4Al2Cl7- | |
| D. | 充电时,Cn为阳极,电极方程式为Cn+AlCl4--e-═Cn[AlCl4] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1+Q2+Q3 | B. | 1.5Q1-0.5Q2+0.5Q3 | ||
| C. | 0.5Q1-0.5Q2+0.5Q3 | D. | 0.5(Q1+Q2+Q3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com