
| A、盐酸滴入氨水中:H++OH-=H2O |
| B、Na2S的水解反应:S2-+2H2O=H2S↑+2OH- |
| C、在碳酸氢镁溶液中加入足量Ca(OH)2溶液:Mg2++2HCO3-+Ca2++2OH一=MgCO3↓+CaCO3↓+2H2O |
| D、铜片插入硝酸银溶液中:Cu+2Ag+=Cu2++2Ag |


科目:高中化学 来源: 题型:
 Q、R、T、X、Y五种元素的原子序数依次递增,Y的原子序数为29,R、T、X在周期表中的位置如右图所示.R原子基态时2p原子轨道上有3个未成对的电子,Q、X 分别得到一个电子后均形成稀有气体原子的稳定结构.请回答下列问题:
Q、R、T、X、Y五种元素的原子序数依次递增,Y的原子序数为29,R、T、X在周期表中的位置如右图所示.R原子基态时2p原子轨道上有3个未成对的电子,Q、X 分别得到一个电子后均形成稀有气体原子的稳定结构.请回答下列问题:| R | ||
| T | X |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烯烃使酸性高锰酸钾溶液褪色 |
| B、在家中燃烧液化石油气做饭 |
| C、乙酸与乙醇反应生成乙酸乙酯 |
| D、用装有酸性重铬酸钾的装置检验司机是否酒后驾车 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 设nA为阿伏加德罗常数的值,下列叙述正确的是( )
设nA为阿伏加德罗常数的值,下列叙述正确的是( )| A、常温常压下,16g14CH4所含中子数目为8nA |
| B、标准状况下,22.4 LCCl4所含分子数目为nA |
| C、1 L 0.5 mol?L-1的CH3COONa溶液中所含的CH3COO-离子数目为0.5nA |
| D、6.2g白磷(分子式为P4,分子结构如图所示)所含P-键数目为0.3nA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
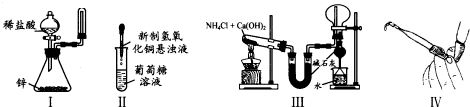
| A、实验I:制取并收集氢气 |
| B、实验II:验证葡萄糖的还原性 |
| C、实验III:实验室制氨气并收集干燥的氨气 |
| D、实验Ⅳ:检查碱式滴定管是否漏液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究.
小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究.| 实验操作 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com