
| A. | 浓硫酸稀释时,应将水沿器壁慢慢倒入浓硫酸中,并不断用玻璃棒搅拌 | |
| B. | 浓硫酸不分解,不挥发,所以可以敞口放置于空气中 | |
| C. | 浓硫酸具有氧化性,稀硫酸无氧化性 | |
| D. | 可以用铁罐或铝槽车来运输冷的浓硫酸 |
分析 A.浓硫酸与水加入顺序错误;
B.浓硫酸具有吸水性;
C.稀硫酸中+1价氢化合价在反应中能够降低;
D.浓硫酸具有强的氧化性,常温下能够使铁、铝钝化.
解答 解:A.浓硫酸稀释正确的操作:浓硫酸稀释时,应将浓硫酸沿器壁慢慢倒入水中,并不断用玻璃棒搅拌,故A错误;
B.浓硫酸具有吸水性,敞口放置于空气中会吸收空气中水,浓度减小,故B错误;
C.稀硫酸中+1价氢化合价在反应中能够降低,所以稀硫酸也具有氧化性,故C错误;
D.浓硫酸具有强的氧化性,常温下能够使铁、铝钝化,形成致密的氧化膜,所以可以用铁罐或铝槽车来运输冷的浓硫酸,故D正确;
故选:D.
点评 本题考查了元素化合物知识,熟悉浓硫酸的吸水性、脱水性、强的氧化性是解题关键,题目难度不大,注意钝化是化学变化.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
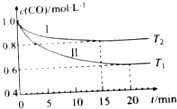 为了减少CO对大气的污染,某科研小组在一个体积为1L的容积不变的密闭容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反应转化为绿色能源H2,不同温度下,CO的浓度[c(CO)]随时间[t]变化的曲线如图所示.
为了减少CO对大气的污染,某科研小组在一个体积为1L的容积不变的密闭容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反应转化为绿色能源H2,不同温度下,CO的浓度[c(CO)]随时间[t]变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | 过量Ba(OH)2溶液与少量的NaHCO3溶液混合Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| C. | 石英溶于NaOH溶液:Si4++2O2-+2OH-=SiO32-+H2O | |
| D. | 硅酸钠溶液中滴加盐酸:SiO32-+2H+═H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②⑤⑥ | C. | ③④ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大 | |
| B. | 将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的$\frac{1}{2}$ | |
| C. | 相同浓度的HCl和CH3COOH,两溶液中c(H+)相同 | |
| D. | 甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的中c(H+)之比为10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )| A. | 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 | |
| B. | 甲装置中阴极的反应为Fe-2e-═Fe2+ | |
| C. | 为了增加污水的导电能力,应向污水中如入适量的NaOH溶液 | |
| D. | 当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
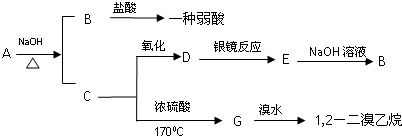
 2CH3CHO+2H2O.
2CH3CHO+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com