
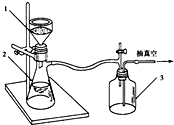
 ����������Ϊһ�ֳ���ҩ�����н�����ʹ��Ч����ʵ�����Ʊ���������ʱ�������ñ���������������������������ȡ���������������ķ�Ӧ����Զ����������ᷴӦ�����ʣ�
����������Ϊһ�ֳ���ҩ�����н�����ʹ��Ч����ʵ�����Ʊ���������ʱ�������ñ���������������������������ȡ���������������ķ�Ӧ����Զ����������ᷴӦ�����ʣ�| ���� | ʽ�� | ��״ | �ܶ�/g/cm3 | �е�/�� | �ܽ�� |
| ���� | 93 | ��ɫ��״Һ�壬���л�ԭ�� | 1.02 | 184.4 | ����ˮ���������Ҵ������ѵ� |
| �������� | 135 | ��ɫ���� | 1.22 | 304 | ������ˮ��������ˮ���������Ҵ������� |
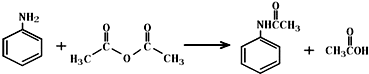
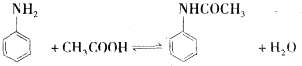 ��
������ ��1�����������ᷢ��ȡ����Ӧ��������������ˮ��
��2������������Ϣ����������ˮ���������Ҵ������ѣ���������������ˮ��������ˮ���������Ҵ������ѡ�����ѡ�õ�ϴ���Լ���
��3�����������Ϣ�����ˢ��Ŀ���dz�ȥ����̿�����ó�����ʹ����ƿ�е�ѹǿ���ͣ����ٴﵽ��Һ�����Ŀ�ģ��������̫���¶Ƚ��͵��²���������Ӱ����ʣ�
��4������������ܼ���Ŀ����Ҫ�DZ����ܼ�����ʧ���¶ȵĽ��Ϳ��ܵ��²���������Ӱ����ʣ�
��5������ʵ������Բ���������������Ӱ����н����٢ڢ۵Ĵ��ڶ����Խ���������������ʧ�����ܲ�Ӱ����ʡ��ݻή�Ͳ��ʣ�
��6�������������ݼ���������������������ʵ�����Ȼ����ݲ���������������������������ʵ������ٸ���ʵ�������ɵ�����������������������ʣ�
��� �⣺��1�����������ᷢ��ȡ����Ӧ��������������ˮ������ʽΪ��
�ʴ�Ϊ�� ��
��
��2������������ˮ��������������������ˮ����������ˮ�����Կ�����ˮϴ�Ӵֲ�Ʒ�����������Ӷ���ȥ���е����ʣ�����B��ȷ��
�ʴ�Ϊ��B��
��3�����ݲ���۲���������֪�����ˢ��Ŀ���dz�ȥ������ɫ���ʵĻ���̿��������֪�������ȣ����˵��ŵ��Ǽӿ�������ʣ����ٴﵽ��Һ�����Ŀ�ģ���ֹ����̫���¶Ƚ��͵�����������������Ӱ����ʣ��ʴ�Ϊ����ȥ������ɫ���ʵĻ���̿�����ٴﵽ��Һ�����Ŀ�ģ���ֹ����̫���¶Ƚ��͵�����������������Ӱ����ʣ�
��4������������ܼ������Ա����ڲ������������ܼ�����ʧ���¶ȵĽ����������Ӱ����ʣ������̿���������أ�����AB��ȷ��
�ʴ�Ϊ��AB��
��5�������Ƴɱ�����Һ�������20%���ܼ������Է�ֹ���������У��ܼ���ʧ���¶Ƚ��Ϳ��ܵ��µIJ�����������������߲��ʣ�
�ڳ��ȹ��˽�����Һ�������������ܽ�����¶�Ӱ��ϴϸ��¶��¿��Լ����ڹ��˹����е��²�����٣���������߲��ʣ�
�۹��ˢ�ʱ��������ˮ��ϴ�ձ���©���еĹ��壬�ϲ���Һ�������ձ���©�����в����IJ��������߲���
�ܼӻ���̿������ɫ���ʣ�����߲��ʣ�
�ݹ��ˢ�ʱ��ϴ��ѡ����ˮ������ˮϴ�ӹ��壬���������������ܽ��������ʧ�����������϶࣬�����˲��ʣ�
�������Ϸ�����֪��������߲��ʵ��У��٢ڢۣ�������߲��ʵ�Ϊ���ܢݣ�����C��ȷ��
�ʴ�Ϊ��C��
��6��5.0mL�������ܶ�1.04g/mL�������ʵ���Ϊ��$\frac{1.04g/mL��5.0mL}{93g/mol}$��0.056mol��
6.0mL���������ܶ�1.08g/mL�������ʵ���Ϊ��$\frac{1.08g/mL��6.0mL}{102g/mol}$��0.064mol��
�����������������Ϸ�Ӧ�����������������ʵ���Ϊ0.056mol��
���ʵ�����������IJ���Ϊ��$\frac{6.75g}{135g/mol��0.056mol}$��100%��89%��
�ʴ�Ϊ��89%��
���� ���⿼���л���ĺϳɡ��л���ѧʵ�顢���ʵķ����ᴿ���Բ�������ķ������۵ȣ������漰֪ʶ��϶ࡢ�ۺ��Խ�ǿ����ȷ�Ʊ�ԭ��Ϊ���ؼ����Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ���߱���ʵ�Ļ������ѶȽϴ�


 ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
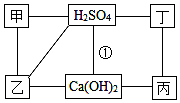 ��ͼ�е�ÿ�����߱�ʾ���˵����ʿ��Է�����ѧ��Ӧ���ס��ҡ��������ֱ�ΪMg��BaCl2��Na2CO3��HCl�е�һ�֣�
��ͼ�е�ÿ�����߱�ʾ���˵����ʿ��Է�����ѧ��Ӧ���ס��ҡ��������ֱ�ΪMg��BaCl2��Na2CO3��HCl�е�һ�֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪�����ۻ���Ϊ6.0 kJ/mol�������������Ϊ20 kJ/mol������1 mol������2 mol ��������ۻ�����ȫ�����ƻ���������������ֻ���ƻ�����15%����� | |
| B�� | ͬ��ͬѹ�£�H2��g��+Cl2=2HCl��g���ڹ��պ͵�ȼ�����µġ�H��ͬ | |
| C�� | ʵ���û����飨l��������ϩ��l���ͱ���l���ı�ȼ���ȷֱ�Ϊ-3916 kJ/mol��-3747 kJ/mol��-3265 kJ/mol������֤���ڱ������в����ڶ�����̼̼˫�� | |
| D�� | ��ӦA��g��?2B��g����������Ӧ�Ļ��ΪEa kJ/mol���淴Ӧ�Ļ��ΪEb kJ/mol����÷�Ӧ�ġ�H=��Ea-Eb�� kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
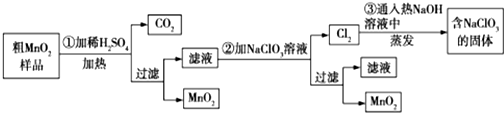
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪��HI��g��?$\frac{1}{2}$H2��g��+$\frac{1}{2}$I2��s����H=-26.5 kJ•mol-1���ɴ˿�֪1 mol HI�������ܱ������г�ַֽ����Էų�26.5 kJ������ | |
| B�� | ��֪��2H2��g��+O2��g���T2H2O��l����H=-571.6 kJ•mol-1����������ȼ���ȡ�H=-571.6 kJ•mol-1 | |
| C�� | �£�N2H4����һ�����ڻ����ȼ�ϵ�ص�ԭ�ϣ���֪2H2O��g��+O2��g���T2H2O2��l����H1=+108.3 kJ•mol-1���� N2H4��l��+O2��g���TN2��g��+2H2O��g����H2=-534.0 kJ•mol-1���� ���з�Ӧ��N2H4��l��+2H2O2��l���TN2��g��+4H2O��l����H=-642.3 kJ•mol-1 | |
| D�� | ��20.0 g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7 kJ����������ϡ�����ϡNaOH��Һ��Ӧ���Ȼ�ѧ����ʽΪNaOH��aq��+CH3COOH��aq���TCH3COONa��aq��+H2O��l����H=-57.4 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
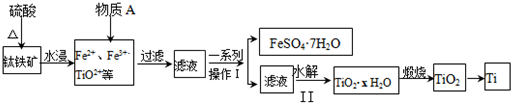
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ȼ���ȡ�H=-890.3 kJ•mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+$\frac{3}{2}$O2��g��=CO��g��+2H2O��g����H=-890.3kJ•mol-1 | |
| B�� | �к��Ȳⶨʵ���е���ֹ�¶Ⱦ���ʵ������л��Һ������¶� | |
| C�� | Ϊ�˼��ٴ����е���������Ȼ���ս���Ϊһ�ֱ��ܹ�ע�Ŀ������������Դ | |
| D�� | ͬ��ͬѹ�£�H2��g��+Cl2��g��=2HCl��g���ڹ��պ͵�ȼ�����µġ�H��ͬ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com