
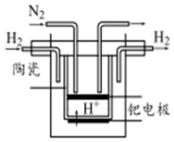
 氮的固定对工农业及人类生存具有重大意义.
氮的固定对工农业及人类生存具有重大意义.分析 (1)依据反应自发进行的判据:△H-T△S<0解答;
(2)利用平衡三行式,结合平衡常数的涵义计算此反应的平衡常数;保持容器体积不变,再向容器中加入lmolN2,3molH2,相同于原容器在恒温条件下2molN2、6molH2建立平衡,依据等效平衡理论,相当于由2倍容器体积的基础上再缩小到原体积,据此判断平衡移动的方向,确定氢气的转化率变化;
(3)标准状况下,若将22.4mL的氨气,即0.001mol氨气通入100mLpH为2的盐酸中(HCl的物质的量为0.001mol),所得溶液为NH4Cl,结合离子的水解和电荷守恒判断各离子浓度的大小;
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,过滤得滤液为(NH4)2SO4溶液,根据反应原理可知同时得到碳酸钙沉淀,结合原子守恒可写出此反应的化学方程式;
(5)氮气在阴极得电子生成氨气;
(6)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),据此分析.
解答 解:(1)反应N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)的△S<0,根据△H-T△S<0可知△H<0,选项D正确,故答案为:D;
(2)N2(g)+3H2(g)?2NH3(g)
起始物质的量(mol/L) 1 3 0
变化物质的量(mol/L) 0.6 1.8 1.2
平衡物质的量(mol/L) 0.4 1.2 1.2
K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{1.{2}^{2}}{0.4×1.{2}^{3}}$=2.08,
保持容器体积不变,再向容器中加入lmolN2,3molH2,相当于在2L容器中加入2molN2、6molH2反应达到平衡时再缩小体积到1L,此时平衡正向移动,氢气的转化率增大;
故答案为:2.08;增大;
(3)标准状况下,若将22.4mL的氨气通入100mLpH为2的盐酸中得到NH4Cl溶液,NH4+的水解使得溶液显酸性,即c(H+)>c(OH-),再结合溶液中的电荷守恒可知溶液中各离子浓度的顺序由大到小为c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,可得到碳酸钙沉淀,同时过滤得滤液为(NH4)2SO4溶液,发生反应的化学方程式为CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,故答案为:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;
(5)电解池中氮气在阴极得电子生成氨气,其电极方程式为:N2+6e-+6H+=2NH3,故答案为:N2+6e-+6H+=2NH3;
(6)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),△H=(-92.4kJ•mol-1)×2-(-571.6kJ•mol-1)×3=+1530 kJ•mol-1;
故答案为:+1530 kJ•mol-1.
点评 本题考查了熵变与焓变的应用、平衡常数的应用、等效平衡的应用、溶液中离子浓度的大小比较、电解原理的应用、盖斯定律的应用等,题目难度中等,侧重于基础知识的综合应用考查,重点是平衡常数的计算及能量的计算.


科目:高中化学 来源: 题型:解答题
 根据所学的物质结构的相关知识回答下列问题:
根据所学的物质结构的相关知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ③⑤ | C. | ①②⑤ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
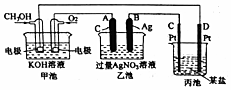
| A. | 用NaOH溶液除去铝箔表面的氧化膜 Al2O3+2OH-═2AlO2-+H2O | |
| B. | 向AlCl3溶液中加入过量氨水 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用胃舒平(复方氢氧化铝)缓解胃酸(HCl)过多 OH-+H+═H2O | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体Al3++3H2O?Al(OH)3 (胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
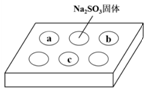 某同学进行SO2的性质实验.在点滴板a、b、c处分别滴有不同的试剂,再向Na2S
某同学进行SO2的性质实验.在点滴板a、b、c处分别滴有不同的试剂,再向Na2S| 序号 | 试剂 | 实验现象 |
| a | 品红溶液 | 红色褪去 |
| b | 酸性KMnO4溶液 | 紫色褪去 |
| c | NaOH溶液(含2滴酚酞) | 红色褪去 |
| A. | 浓硫酸与Na2SO3固体发生了氧化还原反应 | |
| B. | a、b均表明SO2具有漂白性 | |
| C. | c中只可能发生反应:SO2+2OH-═SO32-+H2O | |
| D. | c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 项目名称 | 数据 | 参考值 |
| 尿素氮 | 3.95 | 2.00-6.10 m mol•L-1 |
| 葡萄糖 | 4.50 | 3.89-6.11 m mol•L-1 |
| 总胆固醇 | 3.80 | <5.20 m mol•L-1 |
| 甘油三酯 | 1.85↑ | <1.70 m mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com