
| A. | Mg2+、Al3+、Cl-、OH- | B. | Na+、Ba2+、OH-、SO42- | ||
| C. | K+、Na+、NO3-、HCO3- | D. | K+、NH4+、CO32-、OH- |
分析 A.镁离子、铝离子与氢氧根离子反应;
B.钡离子与硫酸根离子反应生成硫酸钡沉淀;
C.四种离子之间不反应,能够共存;
D.铵根离子与氢氧根离子反应.
解答 解:A.Mg2+、Al3+都与OH-发生反应,在溶液中不能大量共存,故A错误;
B.Ba2+、SO42-之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故B错误;
C.K+、Na+、NO3-、HCO3-之间不发生反应,在溶液中能够大量共存,故C正确;
D.NH4+、OH-之间发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:推断题
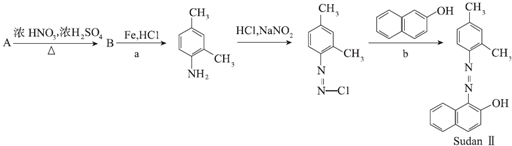
 .
.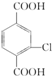 +4NaOH→
+4NaOH→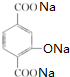 +NaCl+3H2O.②E→F
+NaCl+3H2O.②E→F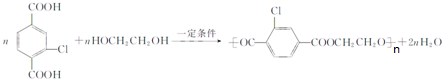 .
.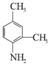 和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.
和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
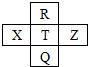 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是( )| A. | 非金属性:X<T<Z | B. | 第一电离能:Z<X<T | ||
| C. | 最高价氧化物的水化物酸性:Q<T<R | D. | 气态氢化物的还原性:R<T<X |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,44 g的N2O和CO2混合气体含有的分子数为NA | |
| B. | 1 mol Fe粉与1 mol水蒸气充分反应转移的电子数为2NA | |
| C. | 标准状况下,1 L乙醇完全燃烧产生CO2分子的数目为$\frac{{N}_{A}}{22.4}$×2 | |
| D. | 1 mol CH3+中含有电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 | |
| D. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| FeS04•7H2O | (NH4)2SO4 | FeSO4•(NH4)2SO4•6H2O | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| B. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{HCl(aq)}{→}$SiCl4 | |
| C. | Al2O3 $→_{△}^{NaOH(ap)}$ NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| D. | Fe2O3$\stackrel{H_{2}SO_{4}(aq)}{→}$Fe2(SO4)3(aq)$\stackrel{△}{→}$无水Fe2(SO4)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com