
���� ��1�����ݸ�˹���ɿ�֪����Ӧ��ֻ��ʼ̬����̬�йأ����뷴Ӧ��;���أ�ͨ���۲��֪;�����;�����ǵ�Ч�ģ�����;����ų�����������;����ų���������
��2���ɸ�˹���ɣ���;�����������ѧ����ʽ�����ʵ���ϵ�����мӼ�����Ӧ��Ҳ������Ӧ��ϵ��������Ӧ�ļӼ��������;��I���Ȼ�ѧ����ʽ���ݴ��жϡ�H1����H2����H3����H4����ѧ��ϵʽ��
����֪�Ȼ�ѧ����ʽ�����ʵ���ϵ�����мӼ�����Ӧ��Ҳ������Ӧ��ϵ��������Ӧ�ļӼ�������Ŀ���Ȼ�ѧ����ʽ��
��3������ȼ���ȸ�����1mol��ȼ����ȫȼ�������ȶ�������ų����������������������32g�״�ȼ�����ɶ�����̼��Һ̬ˮ���ȣ�����Ȼ�ѧ����ʽ��д��������ע���ʾۼ�״̬�Ͷ�Ӧ�ʱ䣻
��4����ѧ��Ӧ�У���ѧ�����������������γ��»�ѧ���ų����������ݷ�Ӧ��=��Ӧ����ܼ���-��������ܼ��ܼ��㷴Ӧ�ȣ��ݴ˷������
��5�������Ȼ�ѧ����ʽ��˹���ɼ���õ������Ȼ�ѧ����ʽ�����ݸ�˹���ɢ�-I��2�õ���
��6����֪��CH4��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O��g����H=-574kJ•mol-1����CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g����H=-1 160kJ•mol-1����H2O��l��=H2O��g����H=+44kJ•mol�����ø�˹���ɽ�$\frac{��+��-4����}{2}$�ɵ�CH4��g��+2NO2��g���TN2��g��+CO2��g��+2H2O��l������H=-$\frac{574+1160+4��44}{2}$kJ•mol-1=-955kJ•mol-1��
��� �⣺��1�����ݸ�˹���ɿ�֪����Ӧ��ֻ��ʼ̬����̬�йأ����뷴Ӧ��;���أ�ͨ���۲��֪;�����;�����ǵ�Ч�ģ�;�����;���������úȼ�����ĵ�������ȣ���;������������ֻ�ж�����̼������;����ų�����������;����ų���������
�ʴ�Ϊ�����ڣ�
��2��;����C��s��+H2O��g���TCO��g��+H2��g����H2��0 ��
��ȼ��ˮú����2CO��g��+O2��g���T2CO2��g����H3��0 ��
2H2��g��+O2 ��g���T2H2O��g����H4��0 ��
�ɸ�˹���ɿ�֪���ڡ�2+��+�ܵ�2C��s��+2O2 ��g���T2CO2��g����H=2��H2+��H3+��H4��
���ԡ�H1=$\frac{1}{2}$��H=$\frac{1}{2}$��2��H2+��H3+��H4��=��H2+$\frac{1}{2}$����H3+��H4����
�ʴ�Ϊ����H1=��H2+$\frac{1}{2}$����H3+��H4����
��2����25�桢101kPa�£�1g�״���CH3OH��ȼ������CO2��Һ̬ˮʱ����22.68kJ��32g�״�ȼ�����ɶ�����̼��Һ̬ˮ�ų�����Ϊ725.76KJ�����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H=-725.76kJ•mol-1��
�ʴ�Ϊ��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H=-725.76kJ•mol-1��
��3����֪��H-H����Ϊa kJ/mol��N��N����Ϊb kJ/mol��N-H����Ϊc kJ/mol�����ڷ�ӦN2��g��+3H2��g��=2NH3��g���ķ�Ӧ�ȣ���H=��Ӧ����ܼ���-��������ܼ���=3akJ•mol-1+bkJ•mol-1-ckJ•mol-1��6=��3a+b-6c��kJ•mol-1��
�ʴ�Ϊ��3a+b-6c��
��4���ɷ�ӦI��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0 kJ•mol-1
��ӦII��2CO2��g��+6H2��g��?CH3CH2OH��g��+3H2O��g����H=-173.6kJ•mol-1
���ݸ�˹���ɢ�-I��2�ã�2CH3OH��g��=CH3CH2OH��g��+H2O��g����H=-75.6 kJ•mol-1��
�ʴ�Ϊ��2CH3OH��g��=CH3CH2OH��g��+H2O��g����H=-75.6kJ/mol��
��5������CH4��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O��g����H=-574kJ•mol-l
��CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2 O��g����H=-1160kJ•mol-l
��H2O��g���TH2O��l����H=-44.0kJ•mol-l
���ݸ�˹���ɼ���[��+��-�ۡ�4]��$\frac{1}{2}$�õ�CH4��g����NO2��g����Ӧ����N2��g����CO2��g����H2O��l�����Ȼ�ѧ����ʽ��CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��l����H=-955 kJ•mol-1���÷�Ӧ�����������С�ķ�Ӧ����Ӧ���ر��S��0��
�ʴ�Ϊ��CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��l������H=-955 kJ•mol-1������
���� ���⿼���Ȼ�ѧ����ʽ����д�Լ���˹���ɵ�Ӧ�ã�Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬ע����ռ����˼·���Ѷ��еȣ�


 Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O2����������ߵĹ����� | B�� | NaHCO3�����ȶ��Դ���Na2CO3 | ||
| C�� | �Ҵ���������Ʒ�Ӧ�ų����� | D�� | �������Ż�ʱ����ϸɳ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| n��SO32-����n��HSO3-�� | 91��9 | 1��1 | 9��91 |
| pH | 8.2 | 7.2 | 6.2 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2SO4+2NaOH�TNa2SO4+2H2O | B�� | NH3+HCl�TNH4Cl | ||
| C�� | 2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2�� | D�� | CuO+H2$\frac{\underline{\;\;��\;\;}}{\;}$Cu+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ܽ���𡢲���Ĵ�������� | |
| B�� | ����β���к���NO��CO | |
| C�� | Ũ��ˮ�ɼ��������ܵ�©�� | |
| D�� | ��ȡ��������ʱ������ˮ����β�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʣ����� | ʣ���������ʵ���֮�� |
| A | Pb3O4��PbO | 1��1 |
| B | PbO2��Pb3O4 | 1��1 |
| C | PbO2��Pb3O4��PbO | 1��2��1 |
| D | PbO2��Pb3O4��PbO | 1��1��2 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| Y | Z | ||
| M | X |
| A�� | ԭ�Ӱ뾶Z��M | |
| B�� | �ǽ����ԣ�X��Z | |
| C�� | MԪ������������Ӧˮ����������� | |
| D�� | Y������������Ӧˮ��������Ա�X���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
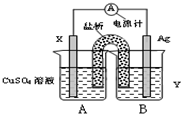 ��ѧ��ѧ����Ҫ����������ʶ��Ȼ������ڵĸ��ָ����ġ�����Ļ�ѧ��Ӧ��̽�����Ļ�ѧ��Ӧ�ı��ʺ��ɣ�ͨ����ѧ��Ӧԭ��ģ���ѧϰ�����ǿ��ԱȽ���̵����⻯ѧ��ѧ�ľ��裬���ѧѧ���������������ѧ��ѧ��Ӧԭ��������������⣮
��ѧ��ѧ����Ҫ����������ʶ��Ȼ������ڵĸ��ָ����ġ�����Ļ�ѧ��Ӧ��̽�����Ļ�ѧ��Ӧ�ı��ʺ��ɣ�ͨ����ѧ��Ӧԭ��ģ���ѧϰ�����ǿ��ԱȽ���̵����⻯ѧ��ѧ�ľ��裬���ѧѧ���������������ѧ��ѧ��Ӧԭ��������������⣮�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com