
| A. | 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 | |
| C. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O | |
| D. | 放电时正极附近溶液的碱性增强 |
分析 根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钠在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,根据电极反应式可判断电子转移的物质的量与反应物之间的关系,充电时,阳极上氢氧化铁转化成高铁酸钠,电极反应式为Fe(OH)3+5OH-=FeO42+4H2O+3e-,阳极消耗OH-离子,碱性要减弱.
解答 解:A、根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,故A正确;
B、放电时正极反应为FeO42+4H2O+3e-=Fe(OH)3+5OH-,每转移3mol电子,正极有1molK2FeO4被还原,故B错误;
C、充电时阳极发生Fe(OH)3失电子的氧化反应,即反应为:Fe(OH)3-3e-+5OH-$\frac{\underline{\;充电\;}}{\;}$FeO42-+4H2O,故C正确;
D、放电时正极反应为FeO42+4H2O+3e-=Fe(OH)3+5OH-,生成氢氧根离子,碱性要增强,pH上升,故D正确.
故选B.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液滴入NaHCO3中:H++AlO2-+H2O=Al(OH)3↓ | |
| B. | 向FeI2溶液中滴加少量氯水:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | 将2.24g铁粉投入400mL 0.3 mol/L的稀HNO3中:4Fe+12H++3NO3-=Fe3++3Fe2++3NO↑+6 H2O | |
| D. | 向含0.5 mol的明矾溶液中逐滴加入0.9 mol Ba(OH)2:5Al3++9SO42-+9Ba2++15OH-=9BaSO4↓+5Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 21.6g | B. | 26.8g | C. | 23.4g | D. | 31.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
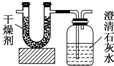 已知某种气态化石燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收).
已知某种气态化石燃料含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收).| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2S | D. | NH3 H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯乙烯使溴水褪色;加成反应 | |
| B. | 乙烯水化生成乙醇;取代反应 | |
| C. | 乙醇与CuO加热反应生成乙醛;氧化反应 | |
| D. | 无水乙醇与浓硫酸加热到170℃制取乙烯;消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 | B. | 0.8 | C. | 0.6 | D. | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸 | |
| B. | 用MgCl2•6H2O制取无水MgCl2时需在HCl气流中进行 | |
| C. | 饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 | |
| D. | 合成氨工业中使用铁触媒做催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com