
【题目】常温下,pH=l 的某溶液 A 中除H+外,还含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、 Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol·L-1。现取该溶液进行有关实验,实验结果如下图所示,下列有关说法正确的是

A. 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B. 实物消耗Cu14.4g,则生成气体丁的体积为3.36L
C. 该溶液一定没有Fe3+,但是无法确定是否含有I-
D. 沉淀乙一定有BaCO3,可能有BaSO4
【答案】A
【解析】pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L。由于pH=1的某溶液中H+浓度为0.1mol/L,则说明溶液中无CO32-。向溶液中加入过量的(NH4)2CO3溶液,生成的无色气体甲为CO2,生成的白色沉淀甲是CO32-和溶液中的弱碱阳离子双水解生成的,由于生成的沉淀为白色,故此弱碱阳离子为Al3+,还能说明溶液中不含Fe3+、Fe2+;向溶液中加入过量的Ba(OH)2溶液,生成的气体乙为NH3,由于前面加入的过量的(NH4)2CO3溶液能引入NH4+,故不能确定原溶液中含NH4+。前面加入的过量的(NH4)2CO3溶液能引入CO32-,故生成的白色沉淀乙一定含BaCO3。向溶液乙中加铜和硫酸,有遇空气变红棕色的气体丙生成,说明溶液中含NO3-.由于溶液显酸性,即含硝酸,则I-不能有。综上分析可知,溶液中一定无CO32-、Fe3+、Fe2+、I-,一定含0.1mol/LH+、0.1mol/LAl3+、0、1mol/LNO3-,由于溶液必须显电中性,且除H+外只能含4种离子,故溶液中一定含Cl-、SO42-。即溶液中一定无NH4+、K+、Na+、CO32-、Fe3+、Fe2+、I-,一定含Cl-、SO42-、H+、Al3+、NO3-。A、该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子,故A正确;B、实验消耗Cu14.4g即0.225mol,设生成的气体丙NO的物质的量为xmol,根据得失电子数守恒可知:0.225mol×2=xmol×3,解得x=0.15mol,则0.15molNO与氧气反应后生成的气体丁NO2也为0.15mol,但由于状态不明确,故NO2的体积不一定是3.36L,故B错误;C、溶液中一定不含I-,故C错误;D、由于原溶液中含SO42-,故沉淀乙一定有BaCO3,也一定含BaSO4,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以最有效的提高尾气处理效果的是 ( )
N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以最有效的提高尾气处理效果的是 ( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A. ①④ B. ②④ C. ① D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用的基准试剂,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾,其中Z的水溶液可用于伤口消毒,其工艺流程图如下:
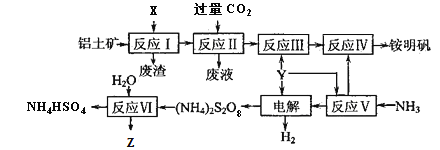
(1)写出反应Ⅱ的离子方程式____________________。
(2)25℃时,将0.2 mol·L-1的氨水与0.1 mol·L-1的Y溶液等体积混合,所得溶液的pH=5,则该温度下氨水的电离常数Kb≈_____________(忽略混合时溶液体积的变化)。
(3)从反应Ⅳ的铵明矾溶液中获得铵明矾晶体的实验操作依次为_____________、____________、过滤、洗涤(填操作名称)。
(4)“电解”时,用惰性材料作电极,则阳极电极反应式为__________________________。
(5)反应Ⅵ的化学方程式为______________________。
(6)废水中含有Fe2+、Mn2+等金属离子对自然环境有严重的破坏作用,,可用(NH4)2S2O8氧化除去。写出Mn2+被氧化生成MnO2的离子方程式为__________________________________。Z也有较强氧化性,在实际生产中不用Z氧化Mn2+的原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】圣路易斯大学研制的新型乙醇燃料电池,使用能传递质子(H+)的介质作溶剂,反应原理为C2H5OH+3O2→2CO2+3H2O,下图是该电池的示意图,下列说法正确的是

A. a极为电池的正极
B. 电池工作时,电流由a极沿导线经灯泡再到b极
C. 电池正极的电极反应为:4H++O2+4e-═2H2O
D. 电池工作时,1mol乙醇被氧化,则电路中有6mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是:
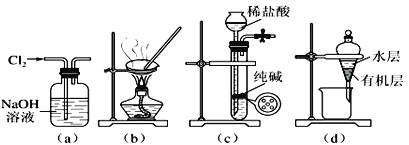
A. 用图(a)所示装置除去氯气中含有的少量氯化氢
B. 用图(b)所示装置蒸发氯化钠溶液制备氯化钠晶体
C. 用图(c)所示装置制取少量纯净的二氧化碳气体
D. 用图(d)所示装置分离苯萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N4分子结构为正四面体(如图所示)。已知:断裂N4(g)中1 molN-N键吸收193kJ能量,形成N2(g)中1 mol N![]() N放出941 kJ能量。下列说法正确的是
N放出941 kJ能量。下列说法正确的是

A. N4(g)比N2(g)更稳定
B. N4(g)=2N2(g) △H=+724kJmol-1
C. 形成1 mol N4(g)中的化学键放出193 kJ的能量
D. lmolN2(g)完全转化为N4(g),体系的能量增加362kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,不正确的是( )

A.制备的乙酸乙酯中混有乙酸和乙醇杂质
B.该实验中浓硫酸的作用是催化和吸水
C.饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇、中和乙酸
D.石蕊层为三层环,由上而下是蓝、紫、红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),下面列举了一些化学键的键能数据,供计算使用
化学键 | Si﹣O | Si﹣Cl | H﹣H | H﹣Cl | Si﹣Si | Si﹣C |
键能/kJ.mol﹣1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)Si(s)+4HCl(g),该反应的逆反应的△H为 ( )
A. ﹣236 kJmol﹣1 B. ﹣412 kJmol﹣1 C. +236 kJmol﹣1 D. +412 kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com