
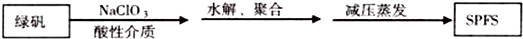
���� ��1�����������ء����Խ��ʣ���������Ӿ��������ԣ��������Ӿ��л�ԭ�ԣ��������ӱ�������
��2��ʵ���ҽ��С�������ʱ�õ�������������̨������Ȧ�����ƾ��ƺ�������������
��3��SPFS����ˮ����ˮ��Ӧ����������������������ˮ�е�������������ˮ��
��4������FeԪ���غ����n��Fe3+��=2n��Fe2O3������ɫ����20.97gΪBaSO4����n��SO42-��=n��BaSO4�����ٸ��ݵ���غ����n��OH-�����ٸ����λ��ȶ���ʽ���㣻
��5���ɾۺ�����������������ϣ�4�����������ʵ�������n��H2O��������n��Fe3+����n��OH-����n��SO42-����n��H2O��������ϵȷ����ѧʽ��
��� �⣺��1�����̷��м������Խ��ʵ�NaClO3Ŀ���ǣ���Fe2+����ΪFe3+��
�ʴ�Ϊ����Fe2+����ΪFe3+��
��2��ʵ���ҽ��С�������ʱ�õ�������������̨������Ȧ�����ƾ��ƺ�������������
�ʴ�Ϊ��������������
��3��SPFS����ˮ����ˮ��Ӧ����������������������ˮ�е�������������ˮ��
�ʴ�Ϊ�������������壻
��4������FeԪ���غ㣺n��Fe3+��=2n��Fe2O3��=$\frac{5.6g}{160g/mol}$��2=0.07 mol��
��ɫ����20.97gΪBaSO4��n��SO42-��=n��BaSO4��=$\frac{20.97g}{233g/mol}$=0.09mol��
���ݵ���غ㣺n��OH-��=3��n��Fe3+��-2��n��SO42-��=3��0.07mol-2��0.09mol=0.03mol��
�����=$\frac{0.03mol}{0.07mol��3}$��100%=14.29%��
�ʴ�Ϊ��14.29%��
��5��n��Fe3+��=0.07 mol��m��Fe3+��=0.07mol��56g/mol=3.92g
n��SO42-��=0.09mol��m��SO42-��=0.09mol��96g/mol=8.64g��
n��OH-��=0.03mol��m��OH-��=0.03mol��17g/mol=0.51g��
m��H2O��=15.05g-3.92g-8.64g-0.51g=1.98g����n��H2O��=$\frac{1.98g}{18g/mol}$=0.11mol
n��Fe3+����n��OH-����n��SO42-����n��H2O��=0.07��0.03��0.09��0.11=7��3��9��11��
�ʸù���ۺ���������Ʒ�Ļ�ѧʽΪ��Fe7��OH��3��SO4��9•11H2O��
�ʴ�Ϊ��Fe7��OH��3��SO4��9•11H2O��
���� �����ۺϿ��黯ѧ�������̡�ʵ�������������ѧ����ȣ��Ƕ�ѧ���ۺ������Ŀ��飬�����йؼ������õ���غ�ȷ�������������ʵ������Ѷ��еȣ�


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
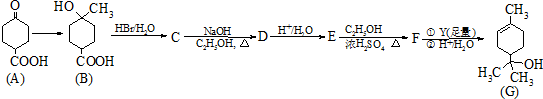
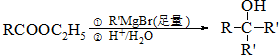
 ��
�� ��
�� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڻ���������Ӧ��ѭ����ɫ��ѧ����˼�� | |
| B�� | ��Ԫ�����ڱ��Ĺ���Ԫ����Ѱ�������Ĵ��� | |
| C�� | ����β���в���NO��ԭ���ǿ����е�N2��O2�����������ڵĸ��»����·�����Ӧ�IJ��� | |
| D�� | ����Ԫ�������ɣ���HClO4�������Ƴ���Ԫ��Ҳ��������������ˮ����HFO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �屽�л����壬��������������Һ�������á���Һ | |
| B�� | ���л��б��ӣ���Ũ��ˮ����� | |
| C�� | �����л�����ϩ��ͨ��ʢ������KMnO4��Һ��ϴ��ƿϴ�� | |
| D�� | ���������л������ᣬ�ɼ�NaOH��Һ�������á���Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
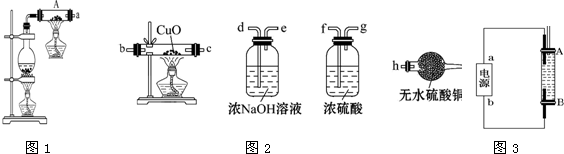
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �е�/�� | |
| SiHCl3 | 33.0 |
| SiCl4 | 57.6 |
| HCl | -84 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c��NO��/��10-3��mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c��CO��/��10-3��mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A�� | 2 s �ڵ�ƽ����Ӧ���ʦԣ�N2��=1.875��10-4 mol•L-1•s-1 | |
| B�� | �ڸ��¶���K=5 | |
| C�� | �����ݻ���СΪԭ����һ�룬NO ת���ʴ���90% | |
| D�� | ijʱ���ٳ���0.1 mol NO��0.36 mol CO�����´�ƽ���CO Ũ�ȱ�ԭƽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
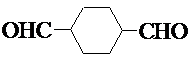
 ������DMP����һ�ֳ��õ������ܻ�����������������������ܶ�Ϊ97����ҵ������DMP��������ͼ��ʾ��
������DMP����һ�ֳ��õ������ܻ�����������������������ܶ�Ϊ97����ҵ������DMP��������ͼ��ʾ��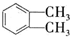 $��_{�ٹ���}^{Cl_{2}}$[A]$\stackrel{��}{��}$[B]$��_{�ۡ�}^{Cu��O_{2}}$[C]$\stackrel{��}{��}$[D]$��_{��ROH/��}^{Ũ����}$[DMP]
$��_{�ٹ���}^{Cl_{2}}$[A]$\stackrel{��}{��}$[B]$��_{�ۡ�}^{Cu��O_{2}}$[C]$\stackrel{��}{��}$[D]$��_{��ROH/��}^{Ũ����}$[DMP]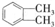 ������1��2-���ױ������ڶ��ױ�����C�й����ŵ�����Ϊȩ����DMP�ķ���ʽΪC10H10O4��
������1��2-���ױ������ڶ��ױ�����C�й����ŵ�����Ϊȩ����DMP�ķ���ʽΪC10H10O4��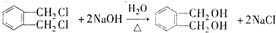 ��
�� ��
�� �Ʊ�DMP����һ��;����
�Ʊ�DMP����һ��;���� $��_{O_{2}��}^{��������}$
$��_{O_{2}��}^{��������}$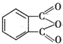 $��_{F��}^{�ʵ�����}$[DMP]
$��_{F��}^{�ʵ�����}$[DMP]�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com