
| A. | N2、H2、NH3的物质的量不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:2:3 | |
| C. | N2与H2物质的量之和是NH3的2倍 | |
| D. | 单位时间里每增加1mol N2,同时增加3mol H2 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、N2、H2、NH3的物质的量不再改变,说明正逆反应速率相等,达平衡状态,故A正确;
B、当体系达平衡状态时,c(N2):c(H2):c(NH3)可能是1:2:3,也可能不是,与各物质的初始浓度及转化率有关,故B错误;
C、平衡时反应物与生成物的物质的量关系取决于反应起始物质的量以及转化的程度,不能用来判断是否达到平衡状态,故C错误;
D、无论是否达到平衡状态,都存在单位时间里每增加1molN2,同时增加3molH2,都是逆反应速率,不能说明正逆反应速率相等,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
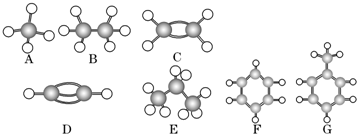
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与溴水混合,振荡静置,溴水层褪色 | |
| B. | 乙烯通入酸性髙锰酸钾溶液中,溶液褪色 | |
| C. | 乙烯通入溴的四氛化碳溶液中,溶液褪色 | |
| D. | 甲烷与氯气混合光照,气体颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
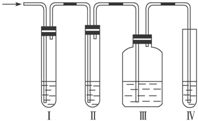 (1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)
(1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的烧瓶 | 若无水硫酸铜不变蓝色,澄清石灰水变浑浊,说明样品全部是PbCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
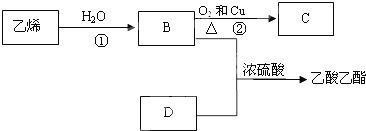

 反应类型:加聚反应.
反应类型:加聚反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com