

| 编号 | 盐酸 | 氢氧化钠 | △t/℃ |
| 1 | 0.1mol•L-1 | 0.05mol•L-1 | 3.5 |
| 2 | 0.1mol•L-1 | 0.1mol•L-1 | x |
| 3 | 0.2mol•L-1 | 0.2mol•L-1 | 14 |
分析 (1)由于盐酸和氢氧化钠发生中和反应放出热量,使瓶内气体温度升高,压强增大,所以U形管内液面左边下降、右边升高;
(2)根据表中数据可知,实验2中生成水的物质的量是实验1中的2倍,实验溶液升高的温度也应该是2倍,即温度差是7℃;
(3)①要保证液体顺利流下,则有关保证内外压强相等,因此可能的原因是没有分液漏斗上部塞子;
②原因稀硫酸具有一定的体积,冒出气泡的原因也可能是加入稀硫酸的体积引起的;所以改进的方法就是在分液漏斗上口和锥形瓶之间连接一导管,使容器内气体体积不变的.
解答 解:(1)盐酸和氢氧化钠发生中和反应放出热量,使瓶内气体温度升高,压强增大,所以U形管内液面左边下降、右边升高,故答案为:U形管内液面左边下降、右边升高;盐酸和氢氧化钠发生中和反应放出热量,使瓶内气体温度升高,压强增大;
(2)根据表中数据可知,实验2中氢氧化钠的浓度增加为实验1的2倍,故生成水的物质的量是实验1中的2倍,实验溶液升高的温度也应该是2倍,即温度差是7℃,
故答案为:7;
(3)①为了保证液体顺利流下,就得保证内外压强相等,故可能的原因是没有分液漏斗上部塞子,故答案为:没打开分液漏斗上部塞子;
②稀硫酸具有一定的体积,冒出气泡也可能是加入稀硫酸的体积引起的;所以改进的方法就是在分液漏斗上口和锥形瓶之间连接一导管,使容器内气体体积不变的,
故答案为:稀硫酸具有一定的体积,冒出气泡的原因可能是加入稀硫酸的体积引起的;分液漏斗上口和锥形瓶之间连接一导管.
点评 本题主要考查的是中和反应实验的综合性题目,难度较大,分别从中和反应放热、实验方案的设计与评价等方面检验了学生的实验能力,是一好题.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
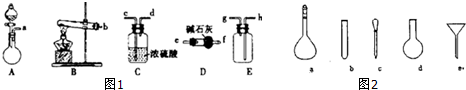
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
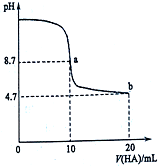 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )| A. | 在逐滴加入HA溶液至20mL时,NaOH溶液中水的电离程度先增大后减小 | |
| B. | b点所示溶液中c(A-)>c(HA) | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | 该酸是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$先增大再减小 | |
| B. | c(NH4+)与c(NH3•H2O)之和始终保持不变 | |
| C. | 水的电离程度始终增大 | |
| D. | 当加入CH3COOH的体积为10mL时,c(NH4+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
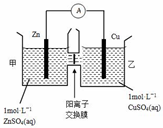
| A. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)减小 | |
| C. | 铜电极上发生氧化反应 | |
| D. | 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A+m}(Z+m)$mol质子 | B. | $\frac{a}{A}(Z+m)$mol电子 | ||
| C. | $\frac{a}{A+m}(A-Z+m)$mol中子 | D. | $\frac{a}{A}$mmol HmX |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
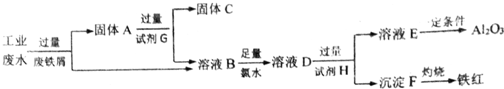
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com