
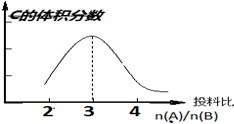
 在恒温恒压条件下:aA(g)+bB(g)?2C(g),以不同的投料比开始反应,分别达到平衡时,C的体积分数与投料比的关系如图所示:
在恒温恒压条件下:aA(g)+bB(g)?2C(g),以不同的投料比开始反应,分别达到平衡时,C的体积分数与投料比的关系如图所示:分析 (1)根据反应物投料之比等于计量数之比时,达到平衡时生成物的体积分数最大来回答;
(2)在300℃的条件下,向2L的恒容容器内加入4molA,2molB,设B的变化浓度是x,
3A(g)+B(g)?2C(g),
初始浓度:2 1 0
变化浓度:3x x 2x
平衡浓度:2-3x 1-x 2x
根据三行式结合平衡常数表达式来计算;
(3)4L的恒容容器内加入6.5molA,3.5molB,1.0molC达到平衡时与(2)中平衡等效,据此回答.
解答 解:(1)化学平衡中,反应物投料之比等于计量数之比时,达到平衡时生成物的体积分数最大,根据图示信息,反应物投料之比等于3:1,所以a=3,b=1,故答案为:3、1;
(2)在300℃的条件下,向2L的恒容容器内加入4molA,2molB,设B的变化浓度是x,
3A(g)+B(g)?2C(g),
初始浓度:2 1 0
变化浓度:3x x 2x
平衡浓度:2-3x 1-x 2x
$\frac{2x}{2-3x+1-x+2x}$=0.5,解得x=0.5,则该温度下的平衡常数为K=$\frac{1.{0}^{2}}{(1-0.5)(2-1.5)^{3}}$=16,故答案为:16;
(3)4L的恒容容器内加入6.5molA,3.5molB,1.0molC达到平衡时与(2)中平衡等效,达到平衡时A的体积分数为$\frac{2-3×0.5}{3-2×0.5}$×100%=25%,故答案为:25%.
点评 本题考查学生化学平衡的特点以及三行式的计算知识,注意知识的归纳和梳理是关键,难度中等.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 跟水反应时,水作氧化剂 | |
| B. | NaH中阳离子半径大于阴离子半径 | |
| C. | 跟液氨反应时,生成氢气外,还生成铵盐 | |
| D. | 与乙醇反应时,放出氢气的速率比与水反应时更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③④ | C. | ①②③ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
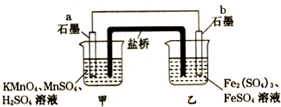 设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )
设计如图原电池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),盐桥中装有饱和溶液.下列说法正确的是( )| A. | 外电路电子的流向是从a到b | |
| B. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| C. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O | |
| D. | 双液原电池工作时产生大量的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱电解质 | H2CO3 | NH3•H2O |
| Ka1 | 4.30×10-7 | 1.77×10-5 |
| Ka2 | 5.61×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com