
【题目】下列物质中含有共价键的是
A. Na2O B. H2O C. CaO D. MgO
科目:高中化学 来源: 题型:
【题目】下列物质中不能通过离子反应一步制取的是( )
①NaHCO3 ②AlCl3 ③Fe3O4 ④SiC ⑤H2S ⑥HNO3
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 中性溶液中:K+、Fe3+、SO42—、Cl—
B. 水电离的c(H+)=1×10—13mol/L的溶液中:K+、Na+、[Al(OH)4]—、CO32—
C. 与Al反应能放出H2的溶液中:Fe2+、Na+、NO3—、SO42—
D.  = 1×10—13mol/L的溶液中:K+、Cu2+、Cl—、NO3—
= 1×10—13mol/L的溶液中:K+、Cu2+、Cl—、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铬及其化合物广泛应用于生活、生产。酒精测量仪的原理是2K2Cr2O7+8H2SO4+3CH3CH2OH=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O,K2Cr2O7遇到CH3CH2OH颜色由橙红色变成绿色。
(1)基态铬原子的价电子排布式为__________。金属离子在水溶液中颜色与未成对电子有关,Cr3+在水溶液中呈绿色。1个基态Cr3+有__________个未成对电子。
(2)1 molCH3COOH 分子中含__________molπ键。CrCl3晶体很稳定,其熔点为83℃,CrCl3晶体熔化时破坏的作用力类型是__________。Cr2(SO4)3中阴离子的立体构型为__________。
(3)乙醇被氧化的中间产物为乙醛(CH3CHO),在乙醇、乙酸和乙醛中,乙醛的沸点最低,其主要原因是________________。乙醛分子中碳原子的杂化类型是__________。
(4)Cr(OH)3是两性氢氧化物,与烧碱溶液反应生成Cr(OH)4-,画出该阴离子的结构图示:__________。
(5)铬、钙和氧组成一种特殊的导电材料(复合氧化物),其晶胞如图所示。

①该晶体的化学式为__________。
②已知该晶体的密度为ρg.cw-3,NA代表阿伏加德罗常数的数值,晶体的摩尔质量为Mg·mol-1。则该晶胞参数(a)为__________pm。
③当该晶体中部分Ca2+被相同数目的La3+替代时,部分铬由+4价转变为+3价。若化合物中Ca2+和La3+的物质的量之比为![]() (x<0.1),则该晶体中+3价铬与+4价铬的物质的量之比为__________ 。
(x<0.1),则该晶体中+3价铬与+4价铬的物质的量之比为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是( )
A. HI和HClO B. HCl和HIO
C. HClO3和HIO D. HClO和HIO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯的含氧衍生物B的相对分子质量为180,其中碳元素的质量分数为60%,氧元素的质量分数为35.6%。请回答下列问题:
(1)B的分子式为_________________。
(2)B是邻位二取代苯,其中一个取代基是羧基,B能发生如图所示转化。

①C→ E的反应体系中含18O的物质有_________种。
②D与足量浓溴水反应的主要产物的结构简式为__________________________________。
③F具有下列哪些化学性质?____________。
A.与浓溴水反应 B.发生加成反应 C.发生氧化反应 D. 发生消去反应
④B与足量NaOH溶液共热的化学方程式为:
________________________________________________________________________。
C的一种同分异构体不能发生水解反应,但能发生银镜反应,其银镜反应的方程式为:_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为__ __;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B____C(填“大于”或“小于”);A、C两元素可组成原子个数比为1:1的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为_ ___;F单质形成的晶体类型为 ,其采用的堆积方式为 。
(4)F元素氧化物的熔点比其硫化物的____(填“高”或 “低”),请解释其原因____。
(5)D跟E可形成离子化合物,其晶胞结构如右图。该离子化合物晶体的密度为pg.cm。3,则晶胞的体积是 。(用含p的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
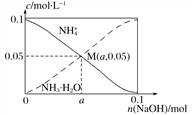
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com