
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
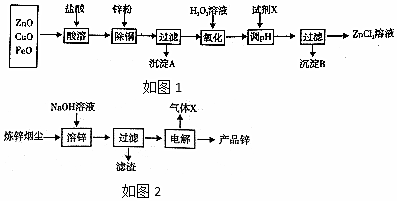
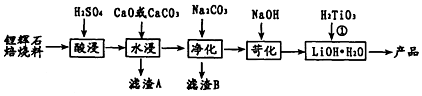
分析 炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)加盐酸溶解,形成氯化锌、氯化铜、氯化亚铁的溶液,加锌粉置换出Cu,过滤,沉淀A为Cu,滤液中含有锌离子和亚铁离子,加入过氧化氢把亚铁离子氧化为铁离子,再加Zn2(OH)2CO3,调节pH,使铁离子转化为氢氧化铁沉淀,过滤除去沉淀,得到氯化锌溶液,
炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)加氢氧化钠溶解:ZnO+2NaOH+H2O═Na2[Zn(OH)4],过滤,电解Na2[Zn(OH)4],溶液,阳极氢氧根离子失电子生成氧气与水阳极反应为:4OH--4e-═2H2O+O2↑,气体X为氧气,阴极上[Zn(OH)4]2-得电子生成Zn与氢氧根离子,则阴极的电极方程式为:[Zn(OH)4]2-+2e-=Zn+4OH-,据此分析解答.
解答 解:(1))“酸溶”后,形成氯化锌、氯化铜、氯化亚铁的溶液,适当加热,加速酸浸速率,温度过高,盐酸挥发,离子的浸出率不高;
故答案为:减少盐酸挥发;
(2)加过氧化氢亚铁离子氧化为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)调节pH使铁离子转化为沉淀,而锌离子不沉淀,由表中数据可知pH≥3.2时,铁离子完全沉淀,而锌离子开始沉淀的pH为5.2,所以要调节pH为3.2≤pH<5.2;若试剂X为Zn2(OH)2CO3,调节pH,使铁离子转化为氢氧化铁沉淀,反应为:3Zn2(OH)2CO3+4Fe3++3H2O=4Fe(OH)3↓+6Zn2++3CO2↑;
故答案为:3.2≤PH<5.2;3Zn2(OH)2CO3+4Fe3++3H2O=4Fe(OH)3↓+6Zn2++3CO2↑;
(4)室温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=3时,c(OH-)=4.0×10-11,溶液中c(Fe3+)=$\frac{Ksp[Fe(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=4.0×10-5;锌离子水解,从ZnCl2溶液中提取无水ZnCl2,为抑制其水解,在氯化氢气体,蒸干氯化锌溶液并加热至失去结晶水;
故答案为:4.0×10-5;在氯化氢气体,蒸干氯化锌溶液并加热至失去结晶水;
(5)ZnO能溶液强碱溶液,CuO和FeO不溶于碱溶液,酸溶液与ZnO、CuO、FeO均能反应,所以炼锌烟尘采用碱溶,而不采用酸溶后电解;
故答案为:氧化铜、氧化亚铁不溶于碱溶液中;
(6)石墨作电极电解时,阳极氢氧根离子失电子生成氧气与水阳极反应为:4OH--4e-═2H2O+O2↑,气体X为氧气;阴极上[Zn(OH)4]2-得电子生成Zn与氢氧根离子,则阴极的电极方程式为:[Zn(OH)4]2-+2e-=Zn+4OH-;
故答案为:O2;[Zn(OH)4]2-+2e-=Zn+4OH-.
点评 本题考查物质的制备工艺流程,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算、电解原理的应用等知识点,是对学生综合能力考查,需要学生具备扎实的基础,题目难度中等


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O | B. | H2SO4+CuO═CuSO4+H2O | ||
| C. | 2 H2S+SO2═3S↓+2H2O | D. | CO2+Ca(OH)2═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
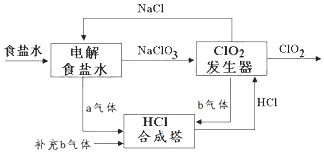 ClO2 是一种高效安全的杀菌消毒剂.用氯化钠电解法生成ClO2的工艺原理示意图如图,发生器内电解生成ClO2.下列说法正确的是( )
ClO2 是一种高效安全的杀菌消毒剂.用氯化钠电解法生成ClO2的工艺原理示意图如图,发生器内电解生成ClO2.下列说法正确的是( )| A. | a气体是氯气,b气体是氢气 | |
| B. | 氯化钠电解槽内每生成2 mol a气体,转移2mol e- | |
| C. | ClO2发生器中阴极的电极反应式为:2ClO3-+12H++10e-═Cl2↑+6H2O | |
| D. | 为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充56L(标准状况)b气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
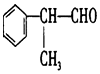 ,该物质是一种香料.
,该物质是一种香料.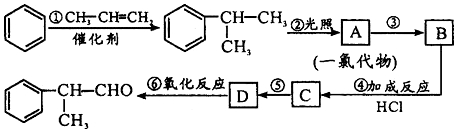
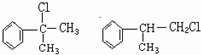 ;
; ;⑥2
;⑥2 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2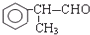 +2H2O.
+2H2O.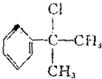 的水解产物
的水解产物 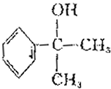 中的-OH不在链端,不能氧化成-CHO.
中的-OH不在链端,不能氧化成-CHO.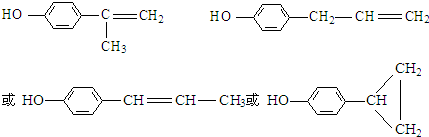 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
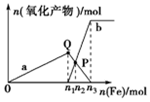 含1mol 溶质HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断正确的是( )
含1mol 溶质HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断正确的是( )| A. | 曲线a表示Fe2+,曲线b表示Fe3+ | |
| B. | P点时总反应的离子方程式可表示为5Fe+16H++4NO3-═3Fe2++2Fe3++4NO↑+8H2O | |
| C. | n2=0.3 | |
| D. | n3:n1=3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
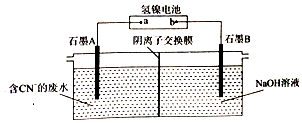
| A. | 电极a为正极 | |
| B. | 负极反应式为MH+OH--e-═H2O+MC | |
| C. | 每消耗1molC N-,理论上导线中通过3mo1e- | |
| D. | 阴极区溶液的PH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| B. | AgNO3$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{△}^{蔗糖}$ Ag | |
| C. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$ Mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com