
| 化学键 | C-C | C-H | Si-Si | Si-H |
| 键能(KJ/mol) | 356 | 413 | 226 | 318 |
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
分析 X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素;Z和U位于第ⅦA族,则Z为F元素,U为Cl;Q基态原子的s轨道和P轨道的电子总数相等,原子序数大于F,核外电子排布为1s22s22p63s2,故Q为Mg;X和Z可形成化合物XZ4,X元素表现+4价,原子序数小于F元素,故X为C元素;X和R属同族元素,则R为Si;T的一种单质在空气中能够自燃,原子序数介于Si与Cl之间,故T为P元素,据此解答.
解答 解:X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素;Z和U位于第ⅦA族,则Z为F元素,U为Cl;Q基态原子的s轨道和P轨道的电子总数相等,原子序数大于F,核外电子排布为1s22s22p63s2,故Q为Mg;X和Z可形成化合物XZ4,X元素表现+4价,原子序数小于F元素,故X为C元素;X和R属同族元素,则R为Si;T的一种单质在空气中能够自燃,原子序数介于Si与Cl之间,故T为P元素,
(1)R为Si元素,基态原子的电子排布式是1s22s22p63s23p2,X为C,所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3,Z为F元素,氢化物的水溶液可与二氧化硅反应,可用于雕刻玻璃,Si为原子晶体,Mg为金属晶体,氯气晶体为分子晶体,熔点由高到低的排列顺序是Si>Mg>Cl2,
故答案为:1s22s22p63s23p2;HNO3;雕刻玻璃;Si>Mg>Cl2;
(2)CuSO4溶液能用作P4中毒的解毒剂,反应生成磷酸和铜,该反应的化学方程式是:P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4,
故答案为:10CuSO4+P4+16H2O→4H3PO4+10Cu+10H2SO4;
(3)在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀,要除去溶液中的Fe2+离子,应先加入适当的氧化剂氯气,将Fe2+氧化为Fe3+,然后加入适当CuO粉末调节溶液pH,以除去Fe3+,
故答案为:在溶液中通入Cl2,再加入CuO粉末调节pH为4~5;
(4)由表中数据可知,C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成,
故答案为:硅烷中的Si-Si键和Si-H键的键能小于烷烃分子中C-C键和C-H键的键能,稳定性差,易断裂,导致长链硅烷难以形成;
(5)NaF与 MgF2为离子晶体,SiF4为分子晶体,离子晶体熔点比分子晶体熔点高,故SiF4的熔点低,影响离子晶体熔点高低的因素为离子半径和电荷,Mg2+的半径比Na+的半径小,MgF2中离子键更强,熔点更高,
故答案为:NaF与MgF2为离子晶体,而SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高;又因为Mg2+的半径小于Na+的半径,所以MgF2中离子键的强度大于NaF中离子键的强度,故MgF2的熔点高于NaF.
点评 本题考查较为综合,多角度考查原子结构与元素周期律知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,根据最外层电子数及原子序数的关系确定元素是解题的关键,注意整体把握元素周期表的结构,难度中等.


科目:高中化学 来源: 题型:解答题
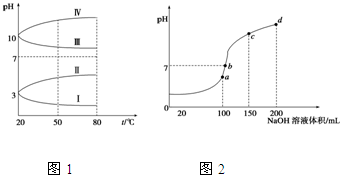
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化产物是O2 | |
| B. | BrF3既是氧化剂又是还原剂 | |
| C. | 当有5mol水参加反应,生成22.4L氧气 | |
| D. | 当反应中转移3NA个电子时,有NA个水分子被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
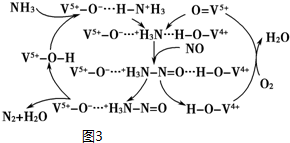
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
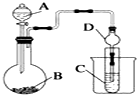 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH21,3-二丁烯 | B. | CH3COOCH2CH2OOCCH3乙二酸二乙酯 | ||
| C. | 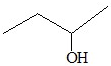 3-丁醇 3-丁醇 | D. | 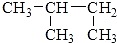 2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
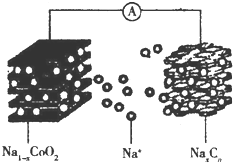 “摇椅型”钠离子电池充放电原理为NaCoO2+Cn$?_{充电}^{放电}$Na1-xCoO2+NaxCn,电池结构如图所示.下列说法正确的是( )
“摇椅型”钠离子电池充放电原理为NaCoO2+Cn$?_{充电}^{放电}$Na1-xCoO2+NaxCn,电池结构如图所示.下列说法正确的是( )| A. | 放电时,Na+向负极移动 | |
| B. | 放电时,钴的化合价升高 | |
| C. | 充电时,阴极的质量减小 | |
| D. | 充电时,阳极的电极反应式为NaCoO2-xe-═Na1-xCoO2+xNa+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com