
进入2013年以来,我国中东部地区多次遭遇大范围、长时间的雾霾天气。车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数K1= 。
③根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
 (2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
(2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
2CO+2NO N2+2CO2 在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。
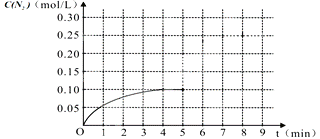
①计算从反应开始到平衡时,平均反应速率v(N2)= 。
②在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时N2的浓度约为
0.25 mol/L)。请在上图中画出第5分钟末到此平衡时N2浓度的变化曲线。
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,在一定条件下,用CH4还原NOX可以消除氮氧化物的污染。
 例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
写出CH4还原N2O4(g)生成N2和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放目的。通过人工光合作用,以CO2和H2O为原
料可以制备HCOOH和O2,计算标况下每回收1.0m3 CO2转移的电子数为 个。
③常温下,0.1mol/L的HCOONa溶液的pH为10,则HCOOH的电离常数Ka = 。
【知识点】化学反应速率、化学平衡常数、盖斯定律
【答案解析】(1)①C+2NO N2+CO2 ②9/16 ③C (2)①0.025mol/(L.min) ②
N2+CO2 ②9/16 ③C (2)①0.025mol/(L.min) ②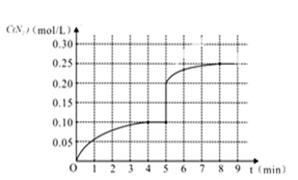
(3)①CH4(g)+N2O4(g)=N2+2H2O(g)+CO2(g)△H=-810.1KJ/mol ② 5.4×1025③10-7mol/L
 解析:
解析:
(1)①根据表格中C、NO 、E、F的初始物质的量及平衡时物质的量之差得到方程式中C、NO 、E、F的系数分别为1、2、1、1,所以方程式为C+2NO N2+CO2
N2+CO2
②将T1℃时的平衡浓度代入平衡常数表达式得上述反应T1℃时的平衡常数K1=0.015×0.015/0.022=9/16 ③由于不知道正反应是吸热还是放热,所以无法判断T1T2的大小。
①v(N2)=0.1mol/L/4min=0.025mol/(L.min) ②在第5分钟末将容器的体积缩小一半后,N2的浓度为0.20mol/L,第8分钟末达到新的平衡(此时N2的浓度约为0.25 mol/L),画图即可。
(3)①根据盖斯定律,用上面的热化学方程式减下面的热化学方程式得:CH4(g)+N2O4(g)=N2(g)+2H2O(g)+CO2(g) △H=-810.1KJ/mol 。②标况下每回收1.0m3 CO2转移的电子数为1.0×1000/22.4×(4-2)×6.02×1023= 5.4×1025
【思路点拨】本题主要考查化学反应速率、化学平衡常数、盖斯定律等知识,理解化学反应速率、化学平衡常数的意义是关键,计算时需认真。


科目:高中化学 来源: 题型:
下列条件下,两瓶气体所含原子数一定相等的是
A.同质量、不同密度的O2和CO B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H6 D.同压强、同体积的N2O和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.乙醇的酯化反应、甲苯的硝化反应以及酯的水解均属于取代反应
B.乙烷生成溴乙烷和乙烯生成溴乙烷的反应类型相同
C.可用氢氧化钠溶液除去乙酸乙酯中混有的乙酸和乙醇
D.蛋白质、淀粉、纤维素、油脂均属于天然高分子化合物,均能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物G的合成路线如下:

(1)D中含氧官能团的名称为,1 molG发生加成反应最多消耗 mol H2
(2)除掉E中含有少量D的试剂和操作是;下列有关E的说法正确的是 (填字母序号)。
A.可发生氧化反应
B.催化条件下可发生缩聚反应
C.可发生取代反应
D.是CH2=CHCOOCH2CH3的同系物
E.易溶于水
(3)写出A→B的化学反应方程式 。
(4)反应E + F→G属于下列麦克尔加成反应类型,则F的结构简式为 。
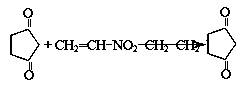
(5)比G少2个氢原子的物质具有下列性质:①遇FeCl3溶液显紫色;②苯环上的一氯取代物只有一种;③1mol物质最多可消耗2mol Na和1mol NaOH。任写一种该物质的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是: ( )
A. 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B. 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C. 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D. 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
50 ℃时,下列各溶液中,离子的物质的量浓度关系正确的是 ( )
A. 在蒸馏水中滴加浓H2SO4,KW不变
B. NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
C.饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中有关物质的量浓度关系和计算不正确的是( )
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:
c(NH4Cl) ﹥c[(NH4)2SO4]﹥c[(NH4)2Fe(SO4)2]
B.已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH约为1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com