
【题目】某学习小组在实验室模拟工业制备硫氰化钾(KSCN)。实验装置如图:
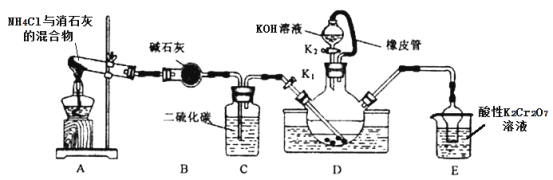
已知:①CS2不溶于水,比水重;NH3不溶于CS2;②三颈烧瓶内盛放有CS2、水和催化剂。
实验步骤如下:
(1)制备NH4SCN溶液:CS2+3NH3![]() NH4SCN+ NH4HS(该反应比较缓慢)
NH4SCN+ NH4HS(该反应比较缓慢)
①实验前,经检验装置的气密性良好。三颈烧瓶的下层CS2液体必须浸没导气管口,目的是_____。
②实验开始时打开K1,加热装置A、D,使A中产生的气体缓缓通入D中,至CS2消失。
则:装置A中反应的化学方程式是_____;装置C的作用是______。
(2)制备KSCN溶液:熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HS= H2S↑ + 3NH3↑),打开K2,再缓缓滴加入适量的KOH溶液,发生反应:NH4SCN + KOH= KSCN + NH3↑ +H2O。
小组讨论后认为:实验中滴加入相同浓度的K2CO3溶液比KOH溶液更好,理由是_____。
(3)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶______,干燥,得到硫氰化钾晶体。
(4)测定晶体中KSCN的含量:称取10.0g样品配成1000mL溶液量取20.00mL于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液做指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN- + Ag+= AgSCN↓(白色)。则判断达到终点时的方法是____。
②晶体中KSCN的质量分数为____。
【答案】使反应物充分接触,防止发生倒吸 2NH4Cl+ Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O 观察气泡流速,以便控制加热温度 K2CO3溶液碱性弱于KOH,且与NH4SCN反应产生更多气体(或K2CO3 + 2NH4SCN
CaCl2+ 2NH3↑+ 2H2O 观察气泡流速,以便控制加热温度 K2CO3溶液碱性弱于KOH,且与NH4SCN反应产生更多气体(或K2CO3 + 2NH4SCN![]() 2KSCN + 2NH3↑ + CO2↑+ H2O),有利于溶液中残留的H2S逸出 过滤,洗涤 滴入一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复 97.0%
2KSCN + 2NH3↑ + CO2↑+ H2O),有利于溶液中残留的H2S逸出 过滤,洗涤 滴入一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复 97.0%
【解析】
(1)①导气管口在液面下,可以使反应物充分接触,据此分析;
②实验室用氯化铵与氢氧化钙来制备氨气;反应为气体参加的装置,装置C中没有化学反应,可观察气泡速率,据此解答;
(2)步骤一中得到了NH4SCN,NH4SCN与KOH反应的方程式已知,K2CO3溶液碱性弱于KOH,且条件可以优化,从该角度考虑作答;
(3)依据实验室制备晶体的基本操作步骤解答。
(1)①导气管口在液面下,可以使反应物充分接触,防止发生倒吸,故答案为:使反应物充分接触,防止发生倒吸;
②实验室用氯化铵与氢氧化钙来制备氨气,其化学方程式为:2NH4Cl+ Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O,装置C是为了观察气泡的速率、控制A装置的加热温度,来控制气体的产生速度。故答案为:2NH4Cl+ Ca(OH)2
CaCl2+ 2NH3↑+ 2H2O,装置C是为了观察气泡的速率、控制A装置的加热温度,来控制气体的产生速度。故答案为:2NH4Cl+ Ca(OH)2![]() CaCl2+ 2NH3↑+ 2H2O;观察气泡流速,以便控制加热温度
CaCl2+ 2NH3↑+ 2H2O;观察气泡流速,以便控制加热温度
(2)K2CO3溶液碱性弱于KOH,且与NH4SCN反应产生更多气体(或K2CO3 + 2NH4SCN![]() 2KSCN + 2NH3↑ + CO2↑+ H2O),有利于溶液中残留的H2S逸出,故答案为:K2CO3溶液碱性弱于KOH,且与NH4SCN反应产生更多气体(或K2CO3 + 2NH4SCN
2KSCN + 2NH3↑ + CO2↑+ H2O),有利于溶液中残留的H2S逸出,故答案为:K2CO3溶液碱性弱于KOH,且与NH4SCN反应产生更多气体(或K2CO3 + 2NH4SCN![]() 2KSCN + 2NH3↑ + CO2↑+ H2O),有利于溶液中残留的H2S逸出;
2KSCN + 2NH3↑ + CO2↑+ H2O),有利于溶液中残留的H2S逸出;
(3)实验室制备晶体的操作:减压蒸发浓缩,冷却结晶,过滤、洗涤,干燥,故答案为:过滤,洗涤;
(4)①Fe3+与SCN-发生络合反应,显红色,因此当最后一滴AgNO3溶液滴入时,SCN-反应完,红色褪去,并且半分钟内颜色不恢复;
②样品溶解后配成1000mL,只取了20.00mL溶液,相当于稀释了50倍,且KSCN的物质的量为:n(KSCN)=n(AgNO3)=0.1000mol/L×20.00×10-3L=0.002 mol,又KSCN的摩尔质量为:97g/mol,所以KSCN的质量为:m(KSCN)=![]() ×97g/mol×0.002mol=9.7g,故KSCN的质量分数为:
×97g/mol×0.002mol=9.7g,故KSCN的质量分数为:![]() ,故答案为:滴入一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复;97.0%。
,故答案为:滴入一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复;97.0%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有浓度均为0.01mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水。请回答下列问题:
(1)①、②、③、④四种溶液中,水电离出的c(H+)由大到小的顺序是_________(填序号)。
(2)④、⑤、⑥、⑦四种溶液中,c(NH4+)由大到小的顺序是_______(填序号)。
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是_______。
(4)已知T℃时,③溶液的pH=11,该温度下,水的离子积Kw=______________;该温度下,将pH之和为13的NaOH溶液和醋酸溶液等体积混合后,所得溶液呈____(填“酸”“碱”或“中”)性。T℃时,将aL pH=11的NaOH溶液与bL pH=1的H2SO4溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0℃、1.01×105Pa下,有关H2、O2、CH4三种气体的叙述正确的是
A.等体积的三种气体,其物质的量之比等于相对分子质量之比
B.三种气体的密度之比等于摩尔质量之比
C.等质量的三种气体,其体积比等于相对分子质量之比
D.等体积、等密度的三种气体物质的量之比等于相对分子质量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,与5.6L的CH4气体含相同H原子数的硫化氢的质量为___g。
(2)将2mol·L-1Al2(SO4)3和0.2mol·L-1H2SO4溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中c(SO42-)=__mol·L-1。若用容量瓶以质量分数为98%、密度为1.84g/cm3的浓硫酸,配制480mL浓度成0.2mol·L-1 稀硫酸,计算需要量取____mL的浓硫酸。
(3)配平以下方程式___
___K2Cr2O7+___HCl=___KCl+___CrCl3+___Cl2↑+___H2O
上述反应中物质氧化性:___>__,每生成lmolCl2时有__个电子发生转移,氧化剂与还原剂的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1mol/L HCl溶液滴定未知浓度的氢氧化钠溶液,
(1)写出下列仪器名称

A________________。
B________________。
(2)操作可分解为如下几步:
①检查滴定管是否________________。
②用蒸馏水洗涤滴定管2~3次。
③在加入酸、碱反应液之前,洁净的酸式滴定管和碱式滴定管还要分别用所要盛装的酸、碱溶液________________2~3遍。
④分别将酸、碱反应液加入到酸式滴定管、碱式滴定管中,使液面位于滴定管刻度“0”以上________________处。
⑤装标准溶液和待测溶液并调节液面使滴定管尖嘴充满溶液,准确读取并记录初始_______________。
⑥取一定体积的待测液于锥形瓶中加入指示剂
⑦把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点,记下滴定管液面的刻度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定大量共存的是( )
A. 含有AlO2-的溶液中:Na+ 、Al3+、Cl-、K+
B. 常温下由水电离出的c(H+)·c(OH-)=10-20 mol2·L-2的溶液中:Na+、NH![]() 、Cl-
、Cl-
C. 常温下 c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
D. 在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将大烧杯丙扣在甲乙两个小烧杯(口向上)上。向两个小烧杯中分别装入如下表所列的试剂进行实验。实验现象与预测现象不同的是
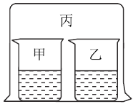
甲中试剂 | 乙中试剂 | 预测现象 | |
A | 浓盐酸 | 硝酸银溶液 | 乙中产生白色沉淀 |
B | 浓氨水 | 硫酸铁溶液 | 乙中产生红褐色沉淀 |
C | 浓盐酸 | 浓氨水 | 丙中产生白色烟雾 |
D | 氯化铝溶液 | 浓氨水并加入 固体氢氧化钠 | 甲中先产生白色沉淀,后又沉淀消失 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A. 使体积不变,增加H2O的量 B. 将容器的体积缩小一半
C. 使体积不变,充氦气使体系压强增大 D. 使压强不变,充氦气使容器体积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,反应①:I2(aq)+I-(aq)![]() I3-(aq) △H1;反应②: I3-(aq)
I3-(aq) △H1;反应②: I3-(aq) ![]() I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
I2(aq)+I-(aq) △H2;反应①的化学平衡常数K1与温度的关系如下表:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K1 | 1100 | 841 | 680 | 533 | 409 |
请回答:
(1)若反应②的化学平衡常数为K2,在相同温度下,K1·K2=____________。
(2)上述反应①的△H1_______0(填“>”、“=”、“<”);若升高温度,则I2的溶解速率会______(填“加快”、“减慢”或“不变”)。
(3)能判断反应①已达到平衡的依据是_______________
A.容器中的压强不再改变 B.溶液的颜色不再改变
C.I-浓度不再变化 D.正逆反应速率均为0
(4)某温度下,反应①的化学平衡常数为800。在该温度下,向甲、乙、丙三个容器中分别加入I2和I-,这两种物质的起始浓度如下:
起始浓度(mol/L) | 甲 | 乙 | 丙 |
c(I2) | 0.1 | 0.2 | 0.2 |
c(I-) | 0.2 | 0.1 | 0.2 |
反应速率最快的是_____________(填“甲”、“乙”或“丙”),平衡时I2的转化率最大的是__________(填“甲”、“乙”或“丙”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com