
【题目】下列机物命名正确的是
A.  ,2-乙基丙烷
,2-乙基丙烷
B. CH3CH2CH2CH2OH,1-丁醇
C.  ,间二甲苯
,间二甲苯
D.  ,2-甲基-2-丙烯
,2-甲基-2-丙烯
【答案】B
【解析】
A、烷烃命名时,要选最长的碳链为主链;
B、饱和一元醇命名时应选择含有官能团羟基的最长碳链做主链;
C、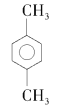 分子中两个甲基处于对位;
分子中两个甲基处于对位;
D、D项、烯烃命名时,要选含有碳碳双键的最长的碳链为主链,从离官能团碳碳双键近的一端给主链上的碳原子进行编号。
A项、烷烃命名时,要选最长的碳链为主链,此烷烃的主链上有4个碳原子,该烷烃的名称为2-甲基丁烷,故A错误;
B项、饱和一元醇命名时应选择含有官能团羟基的最长碳链做主链,该有机物的名称为1-丁醇,故B正确;
C项、 分子中两个甲基处于对位,名称为对二甲苯或1,4—二甲苯,故C错误;
分子中两个甲基处于对位,名称为对二甲苯或1,4—二甲苯,故C错误;
D项、烯烃命名时,要选含有碳碳双键的最长的碳链为主链,从离官能团碳碳双键近的一端给主链上的碳原子进行编号,该烯烃的名称为2-甲基—1—丙烯,故D错误。
故选B。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】按要求完成下列问题
(1)用系统命名法命名下列物质或者依据有机物的名称写出其结构简式:
①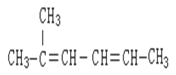 _________________________;
_________________________;
②![]() _____________;
_____________;
③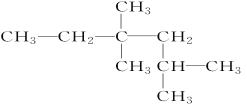 _____________________________;
_____________________________;
(2)下列各组物质中,①属于同位素的是(填字母,下同)________,②属于同素异形体的是________ ,③互为同系物的是__________ ,④属于同分异构体的是____________ ,⑤属于同种物质的是____________ 。
A、O2和O3
B、![]() 和
和![]()
C、CH3CH2C≡CH 和 CH3CH(CH3)2
D、![]() 和
和![]()
E. 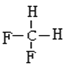 和
和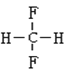
F. 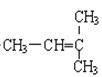 和CH2=CH-CH3
和CH2=CH-CH3
G.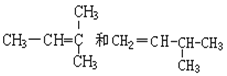
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用废旧电池的铜帽(铜锌总含量约99%)制备了CuSO4·5H2O样品,制备流程如下:
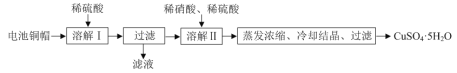
(1)“溶解Ⅱ”过程中,发生反应的离子方程式为___。
(2)“溶解Ⅱ”过程中应控制反应温度,温度不能过高的原因是___。
(3)为测定所得CuSO4·5H2O样品的纯度,兴趣小组进行了如下实验:称取2.540g样品,配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量KI并充分振荡后,滴加几滴淀粉溶液,再滴入0.0400mol·L-1的Na2S2O3溶液至刚好完全反应,恰好完全反应时消耗Na2S2O3溶液的体积为25.00 mL。实验过程中发生的反应如下:2Cu2++4I-=2CuI↓+I2、2S2O32-+I2=S4O62-+2I-
①配制250mL溶液所需的玻璃仪器除烧杯、胶头滴管外还有___。
②计算出样品中CuSO4·5H2O的质量分数。___(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验室某浓盐酸试剂瓶标签上的有关数据,下列说法正确的是

A. 该浓盐酸中HCl的物质的量浓度为11.9mol·L-1
B. 溶液中HCl的物质的量不随所取体积的多少而变化
C. 配制500 mL0.400 mol·L-1的稀盐酸需要量取浓盐酸1.68mL
D. 中和含0.4 g NaOH的NaOH溶液需取0.400 mol·L-1的稀盐酸2.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下列各题中所给出的数据,可分别求出其溶液中溶质的质量分数或溶液中溶质的物质的量浓度,试判断并求解。
(1)已知某氢氧化钠溶液VL中含有n个氢氧根离子,可求出此溶液的___是___。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1:a,则可求出此溶液的___为___。
Ⅱ.常温下,10.0mL1.0molL-1的H2SO4(aq),加水稀释到500mL,所得H2SO4溶液的浓度为___molL-1;蒸发浓缩使溶液的体积为2.40mL,所得H2SO4溶液的浓度为___molL-1。(结果保留小数点后一位)
Ⅲ.已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中溶质的质量分数为___。(结果保留小数点后一位)
Ⅳ.现有一混合物的水溶液,可能含有以下离子中的几种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-现取三份各100mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到![]() 气体;第三份加足量
气体;第三份加足量![]() 溶液后,得到干燥沉淀
溶液后,得到干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 。
。
该混合液中一定含有___,可能含___,且n(K+)___(填取值范围)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“毒鼠强”是一种灭鼠药,具有极强的毒性,国家已禁止使用。它是一种含有C、H、O、N、S的有机物,其摩尔质量为240![]() ;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%,所含氧元素的质量分数为28%,其余为N、S。
;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%,所含氧元素的质量分数为28%,其余为N、S。
(1)误食0.1g “毒鼠强”就可以使人死亡,0.1g “毒鼠强”的物质的量为_______?
(2)试求“毒鼠强”中C、H、O三种元素的原子个数比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我校环保兴趣小组在处理污水样品时,需用2mol/L的盐酸配制成250mL0.1mol/L的盐酸溶液。
(1)计算所需2mol/L的盐酸的体积是_____________。
(2)在容量瓶的使用方法中,下列操作正确的是_______________。
A、使用容量瓶前检查它是否漏水
B、容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C、配制溶液时,将量筒量取好的盐酸直接倒入容量中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(3)配制时其他操作均正确,若定容时俯视刻度线,所配溶液的物质的量浓度_________。(填“偏高”;“偏低”“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.2mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
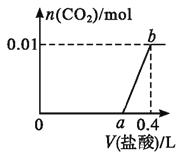
A.在0~a范围内,只发生反应OH-+H+=H2O
B.a=0.35
C.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CH4和 H2O为原料制备二甲醚和甲醇的工业流程如下:
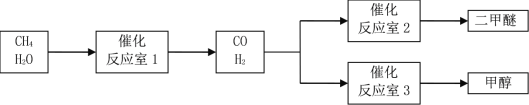
已知:2CO(g)+O2(g)=2CO2(g)△H=-566 kJ·mol-1,CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1,2H2(g)+O2(g)=2H2O(g)△H=-484 kJ·mol-1。
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是_____。
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=_____。
(3)反应室1中发生反应:CH4(g)+H2O (g) ![]() CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
反应时间/min | n(CH4)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
①反应从开始到t1分钟时的平均反应速率为v(H2)=_______mol·L-1·min-1。
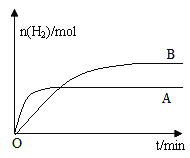
②若保持其他条件不变,起始时向容器中充入0.60 mol CH4和1.20 mol H2O,反应一段时间后,测得容器中H2的物质的量为0.60 mol,则此时v正______v逆(填“>”、“<”或“=”)。
③若上述反应改变某一条件,测得H2的物质的量随时间变化见图中曲线B(A为原反应的曲线),则改变的条件可能是_________。
(4)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如右上图所示。
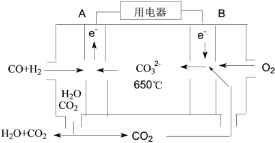
①该电池的正极反应式为_____。
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为________L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com