
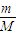 计算1.92g铜物质的量,根据n=cV计算n(H+)、n(NO3-),铜屑投入HNO3和H2SO4的混合溶液中发生的反应:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,结合铜、硝酸根、氢离子的物质的量根据离子方程式进行过量计算,再根据不足的物质计算铜离子的物质的量,结合c=
计算1.92g铜物质的量,根据n=cV计算n(H+)、n(NO3-),铜屑投入HNO3和H2SO4的混合溶液中发生的反应:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,结合铜、硝酸根、氢离子的物质的量根据离子方程式进行过量计算,再根据不足的物质计算铜离子的物质的量,结合c=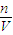 计算铜离子浓度.
计算铜离子浓度. =0.03mol,
=0.03mol, =0.0225mol,
=0.0225mol,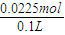 =0.225mol/L,
=0.225mol/L,

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:



| ||


| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
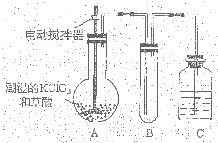 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com