
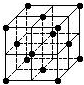
| A. | C60摩尔质量是720 | |
| B. | C60属于离子晶体 | |
| C. | 在C60晶胞中有14个C60分子 | |
| D. | 每个C60分子周围与它距离最近等距离的C60分子有12个 |
分析 A.摩尔质量有单位,若以g/mol作单位,数值上等于其相对分子质量;
B.C60的构成微粒是分子,属于分子晶体;
C.根据均摊法可知,在C60晶胞中面心上的分子属于该晶胞的为$\frac{1}{2}$,顶点上的分子属于该晶胞的为$\frac{1}{8}$;
D.根据晶胞的结构可知,以晶胞中顶点上的C60分子为研究对象,与它距离最近等距离的C60分子分布在立方体的面心上,每个C60分子被8个立方体共用,有12个面与之相连,所以每个C60分子周围与它距离最近等距离的C60分子有12个.
解答 解:A、C60摩尔质量是720g/mol,故A错误;
B、C60属于分子晶体,故B错误;
C.根据均摊法可知,在C60晶胞中含有有C60分子的个数为:6×$\frac{1}{2}$+$8×\frac{1}{8}$=4,故C错误;
D.根据晶胞的结构可知,以晶胞中顶点上的C60分子为研究对象,与它距离最近等距离的C60分子分布在立方体的面心上,每个C60分子被8个立方体共用,有12个面与之相连,所以每个C60分子周围与它距离最近等距离的C60分子有12个,故D正确;
故选D.
点评 本题考查同素异形体、摩尔质量、晶胞的计算及结构等,难度不大,注意摩尔质量的单位是g/mol.


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯的一溴代物没有同分异构体 | B. | 苯的间位二溴代物只有一种 | ||
| C. | 苯能在空气中燃烧 | D. | 苯的邻位二溴代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.
天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.| 温度(℃) | 800 | 1000 | 1200 | 1400 |
| 平衡常数(K) | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn | |
| C. | 若两电极都是金属,则它们的活动性为X>Y | |
| D. | X极上发生的是还原反应,Y极上发生的氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3COO-) | |
| B. | 用0.100 0 mol•L-1NaOH滴定未知浓度的CH3COOH溶液,恰好反应时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)═c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com