
| ||
| ||
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+OH-→H2O+CO32- |
| B、2 HCO3-+Ba(OH)2→BaCO3↓+2H2O+CO32 |
| C、HCO3-+Ba2++OH-→BaCO3↓+H2O |
| D、2 HCO3-+Ba2++2OH-→BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
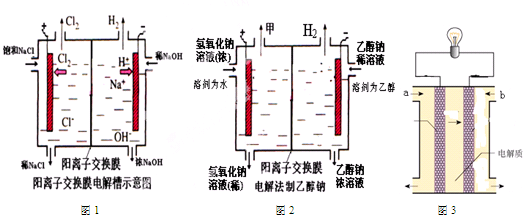
查看答案和解析>>
科目:高中化学 来源: 题型:
 在某容积不变的密闭容器中,可逆反应A(g)+B(g)?xC(g) 符合下列图中所示关系.由此推断对图II的正确说法是( )
在某容积不变的密闭容器中,可逆反应A(g)+B(g)?xC(g) 符合下列图中所示关系.由此推断对图II的正确说法是( )| A、若p3<p4,Y轴可表示B的质量分数 |
| B、若p3>p4,Y轴可表示A的转化率 |
| C、若p3>p4,Y轴可表示混合气体的平均摩尔质量 |
| D、若p3<p4,Y轴可表示混合气体的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
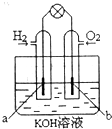 某课外活动小组进行电解饱和食盐水的实验.请同答下列问题.
某课外活动小组进行电解饱和食盐水的实验.请同答下列问题.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2g | B、4g | C、6g | D、8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com