
| A.1∶1 | B.1∶2 | C.2∶3 | D.4∶3 |
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:不详 题型:填空题
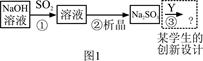
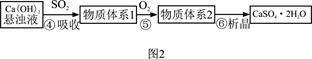
| 试 剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.SO2+H2O H2SO3 H2SO3 |
| B.SO2+2NaOH=Na2SO3+H2O |
C.2SO2+O2 2SO3 2SO3 |
| D.SO2+CaO=CaSO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.小于0.45 mol | B.等于0.45 mol |
| C.在0.45 mol和0.9 mol之间 | D.大于0.9 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖) 6C+6H2O 6C+6H2O |
| B.向AgNO3溶液中加入过量Na2S溶液后,再加NaCl稀溶液,黑色沉淀变成白色:Ag2S + 2Cl- =" 2AgCl↓+" S2- |
C.将NH3通入滴有酚酞的水中,溶液变红:NH3+ H2O  NH3·H2O NH3·H2O  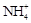 + OH- + OH- |
D.明矾的水溶液pH<7:Al3++ 3H2O  Al(OH)3(胶体)+3H+ Al(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

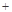 O2
O2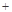 2H2SO4=2CuSO4
2H2SO4=2CuSO4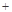 2H2O)
2H2O)| A.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| B.途径③中,1mol Cu与足量浓硫酸反应会产生64g SO2气体 |
C.途径①所用混酸中H2SO4与HNO3物质的量之比最好为 |
D.1mol Cu分别按照途径②、③中,被还原的H2SO4的质量之比为 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com