
ĻĀĮŠ·½³ĢŹ½µÄŹéŠ“»ņĆčŹöÕżČ·µÄŹĒ
A£®ÓĆĢ¼ĖįÄĘČÜŅŗ½žÅŻ¹ųĀÆĖ®¹ø£ŗCaSO4+CO32-
CaCO3”ż+SO42-
B£®ČČ»Æѧ·½³ĢŹ½C2H2£Øg£©+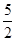 O2£Øg£©
O2£Øg£© 2CO2£Øg£©+H2O£Øg£©£»”÷H=-1256kJ£Æmol£¬±ķŹ¾ŅŅČ²µÄČ¼ÉÕČČĪŖ1256kJ£Æmol
C£®²¬µē¼«µē½āMgCl2±„ŗĶČÜŅŗ£ŗ
D£®H+£Øaq£©+OH£Øaq£©
H2O£Ø1£©£»”÷H=-57£®3 kJ£Æmol£¬±ķŹ¾ŗ¬1 mol NaOHµÄĒāŃõ»ÆÄĘČÜŅŗÓėŗ¬0£®5 mol H2SO4µÄÅØĮņĖį»ģŗĻŗó·Å³ö57£®3 kJµÄČČĮæ
 æ¼Ē°±ŲĮ·ĻµĮŠ“š°ø
æ¼Ē°±ŲĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ·½³ĢŹ½µÄŹéŠ“»ņĆčŹöÕżČ·µÄŹĒ
A£®ÓĆĢ¼ĖįÄĘČÜŅŗ½žÅŻ¹ųĀÆĖ®¹ø£ŗCaSO4+CO32- CaCO3”ż+SO42-
B£®ČČ»Æѧ·½³ĢŹ½C2H2£Øg£©+O2£Øg£©
2CO2£Øg£©+H2O£Øg£©£»”÷H=-1256kJ£Æmol£¬±ķŹ¾ŅŅČ²µÄČ¼ÉÕČČĪŖ1256kJ£Æmol
C£®²¬µē¼«µē½āMgCl2±„ŗĶČÜŅŗ£ŗ
D£®H+£Øaq£©+OH£Øaq£© H2O£Ø1£©£»”÷H=-57£®3 kJ£Æmol£¬±ķŹ¾ŗ¬1 mol NaOHµÄĒāŃõ»ÆÄĘČÜŅŗÓėŗ¬0£®5 mol H2SO4µÄÅØĮņĖį»ģŗĻŗó·Å³ö57£®3 kJµÄČČĮæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2010”Ŗ2011ѧğÕć½Ź”½š»ŖŹ®Š£ø߶žĻĀŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ ĢāŠĶ£ŗµ„Ń”Ģā
ĻĀĮŠ·½³ĢŹ½µÄŹéŠ“»ņĆčŹöÕżČ·µÄŹĒ
| A£®ÓĆĢ¼ĖįÄĘČÜŅŗ½žÅŻ¹ųĀÆĖ®¹ø£ŗCaSO4+CO32- |
B£®ČČ»Æѧ·½³ĢŹ½C2H2£Øg£©+ O2£Øg£© O2£Øg£© |
C£®²¬µē¼«µē½āMgCl2±„ŗĶČÜŅŗ£ŗMgCl2 |
| D£®H+£Øaq£©+OH£Øaq£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013½ģÕć½Ź”ø߶žĻĀŃ§ĘŚĘŚÄ©æ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠ·½³ĢŹ½µÄŹéŠ“»ņĆčŹöÕżČ·µÄŹĒ
A£®µČÖŹĮæµÄĮņÕōĘųŗĶĮņ¹ĢĢå·Ö±šŌŚŃõĘųÖŠĶźČ«Č¼ÉÕ£¬ŗóÕ߷ųöµÄČČĮæ¶ą
B£®ČČ»Æѧ·½³ĢŹ½C2H2£Øg£©+ O2£Øg£©
O2£Øg£© 2CO2£Øg£©+H2O£Øg£©£»”÷H=-1256 kJ”¤mol-1£¬æÉÖŖŅŅČ²µÄČ¼ÉÕČČĪŖ1256 kJ”¤mol-1
C£®ŌŚ101kPaŹ±£¬2gH2ĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³ö285.8kJČČĮ棬ĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ 2H2£Øg£©+O2(g)=2H2O(l) ¦¤H= -285.8 kJ”¤mol-1
D£®Ļ”ČÜŅŗÖŠ£ŗH+£Øaq£©+OH”Ŗ£Øaq)=H2O(l) ¦¤H= ”Ŗ53.7kJ/mol £¬Čō½«ŗ¬0.5 molH2SO4µÄÅØČÜŅŗÓėŗ¬1 mol NaOHµÄČÜŅŗ»ģŗĻ£¬·Å³öµÄČČĮæ“óÓŚ53.7kJ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com