
【题目】I.实验室常用的几种气体发生装置如图A、B、C所示。
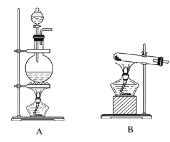
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的试剂是_________;
检查C装置的气密性是否良好的操作方法是____________________________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
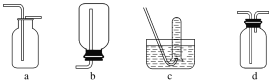
如图是某学生设计收集气体的几种装置,其中不可行的是________。
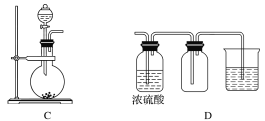
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2
II.镁与稀硝酸的反应为:Mg+HNO3(稀)——Mg(NO3)2+NO↑+H2O(未配平)
(4)该反应中,还原产物是_________,HNO3表现了___________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。
【答案】浓氨水和氧化钙(或碱石灰、固体氢氧化钠等) 关闭分液漏斗的活塞,将导气管通入水槽中,用手或热手巾捂圆底烧瓶,如果导气管处有气泡产生,松开手或拿去热毛巾后,导气管口形成一段稳定的液柱,则说明装置的气密性良好 ②④ b ③ NO 氧化性,酸性
【解析】
I.(1)实验室制取氨气常用Ca(OH)2与NH4Cl在加热条件下制备氨气或用浓氨水在CaO作用下制备氨气,前者需要加热,后者无需加热,如果用C装置,通常使用的药品是浓氨水和CaO;检查C装置气密性是否良好的操作方法是关闭分液漏斗的活塞,将导气管通入水槽中,用手或热手巾捂圆底烧瓶,如果导气管处有气泡产生,松开手或拿去热毛巾后,导气管口形成一段稳定的液柱,则说明装置的气密性良好;故答案为:浓氨水和氧化钙(或碱石灰、固体氢氧化钠等);关闭分液漏斗的活塞,将导管插入水中,用手捂住圆底烧瓶,看到气泡冒出,松开手后,在导管形成一段水柱,说明装置气密性良好;
(2)收集气体的方法的选择可依据气体的密度和溶解性,如气体与氧气反应则只能用排水法收集,气体是否有颜色与收集方法无关,与热稳定性无关;b装置由于气体进入后不能排出集气瓶的空气,所以b装置无法用于收集气体;故答案为:②④;b;
(3)若用A装置与D装置相连制取收集X气体,是固体液体加热制备的气体,气体不能和浓硫酸发生反应,密度比空气重,可以用向上排气法收集,且需进行尾气处理的气体,故:
①CO2制备不需要加热,二氧化碳气体无需尾气吸收装置,故①错误;
②NO 可以制备但不能用排空气法收集,故②错误;
③Cl2是固体和液体加热制备,用浓硫酸干燥,用向上排空气法收集,氯气有毒,不能直接排放到空气中,应有尾气吸收装置,故③正确;
④H2制备不需要加热,氢气比空气轻不能用向上排空气法收集,故④错误;
故答案为:③;
II.(4)该反应中,HNO3中的N元素由+5价转化为NO中的+2价,化合价降低被还原成还原产物,故还原产物是NO,此过程中HNO3表现了氧化性,但是还有部分HNO3中N的化合价并未改变,这部分硝酸则表现了酸性,故答案为:氧化性和酸性。


科目:高中化学 来源: 题型:
【题目】钴是一种中等活泼金属,化合价为+2 价和+3 价,其中 CoCl2易溶于水.某校同学设计实验制取(CH3COO )2Co( 乙酸钴)并验证其分解气体产物.问答下列问题:
(1)甲同学用 Co2O3 与盐酸反应制备CoCl2·4H2O其实验装置如下:
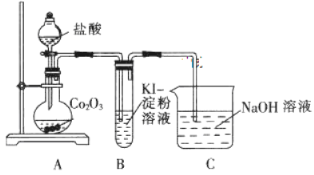
①已知 B 装置中溶液变蓝, 写出烧瓶中发生反应的离子方程式为 _____________。
②由烧瓶中的溶液制取干燥的CoCl2·4H2O,还需经过的操作有蒸发浓缩、__________、洗涤、干燥等。
(2)乙同学利用甲同学制得的CoCl2·4H2O 在醋酸氛围中制得无水(CH3COO)2Co。已知(CH3COO)2Co![]() Co3O4 +CO↑+ CO2↑+ X↑, 该同学称取一 定量的无水(CH3COO )2Co,利用下列装置检验(CH3COO )2Co分解的气体产物(实验过程中同时通入N2),并测定X 的化学式。已知PdCl2溶液可用于检验CO ,它能将CO氧化成 CO2。
Co3O4 +CO↑+ CO2↑+ X↑, 该同学称取一 定量的无水(CH3COO )2Co,利用下列装置检验(CH3COO )2Co分解的气体产物(实验过程中同时通入N2),并测定X 的化学式。已知PdCl2溶液可用于检验CO ,它能将CO氧化成 CO2。
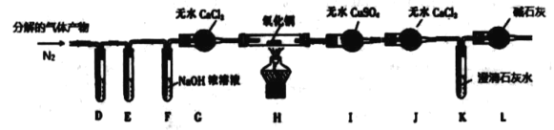
①装置D、E 是用于检验CO 和 CO2的 ,其中盛放PdCl2 溶液的是装置_____(填“D”或“E”)。
②装置F 的作用是__________; 装置L 的作用是__________。
③已知 X 为 二元化合物.假设实验中的每一步反应均完全,实验中观察到装置H 中氧化铜变红,装置I中固体变成蓝色且增重5.4g, K 中石灰水变浑浊且增重8.8g,则X的化学式为_______,写出(CH3COO )2Co 热分解的化学反应化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中,X、Y、Z 三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析
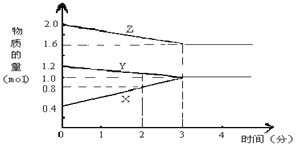
(1)该反应的化学方程式为________。
(2)反应开始至2min末,X的反应速率为_________。
(3)该反应____________。(填序号)
①是可逆反应
②不是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
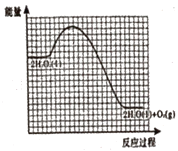
【题目】NH4X(X为卤素原子)有关转化过程的能量关系如图所示。下列说法不正确的是
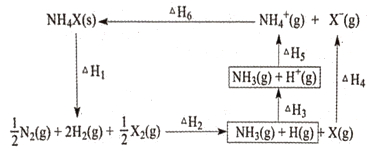
A.ΔH1>ΔH4
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
C.因为NH4Cl固体溶于水吸热,所以ΔH6<0
D.相同条件下,NH4Br的(ΔH2+ΔH3+ΔH5)比NH4I的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图:电流计的指针会偏转,M极变粗,N极变细符合这种现象的是
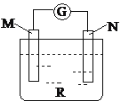
A. M是铜,N是锌,R是硫酸溶液
B. M是锌,N是铜,R是硫酸铜溶液
C. M是银,N是锌,R是硝酸银溶液
D. M是铁,N是铜,R是硝酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热播电视剧《破冰行动》中曾经多次提到一种叫东莨菪碱(Scopolamine)的化学物质。东莨菪碱是1892年由E.施密特首先从东莨菪中分离出来,可用于麻醉、镇痛、止咳、平喘,对动晕症有效。但其毒性较强,稍一过量服用即可致命,具有极高的致幻作用,称为“魔鬼呼吸”。其结构如下图,下列说法不正确的是( )

A. 分子间可以形成分子间氢键
B. 东莨菪碱的化学式为C17H21NO4
C. 该物质能发生加成、取代和氧化反应
D. 可使用质谱仪测出这个分子的相对分子质量,也可用核磁共振氢谱确定这个分子的环状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2O2(l)=2H2O(l)+O2(g) ΔH=-akJ·mol-1(a>0)
(1)KI溶液可作为H2O2分解反应的催化剂,催化过程按以下两步反应进行:
Ⅰ.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) ΔH1=+bkJ·mol-1(b>0)
Ⅱ.__ ΔH2=__kJ·mol-1(用含a和b的代数式表示)
①请将上述过程补充完整(提示:反应Ⅱ不是分解反应)。
②已知:相同条件下,反应Ⅰ的反应速率小于反应Ⅱ的反应速率。如图为未加催化剂时H2O2分解反应的能量-反应历程示意图,请在图中画出加入KI溶液后该反应的能量-反应历程示意图___。
(2)H2O2的水溶液呈弱酸性,其电离过程如下:H2O2H++HO2-;HO2-H++O22-
某温度下,其电离平衡常数K1=1.1×10-11,则质量分数为30%(物质的量浓度为10mol·L-1)的H2O2水溶液的pH≈__。(忽略H2O2的二级电离及水的电离)。
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度![]() ,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是__,原因是__。
,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是__,原因是__。
A.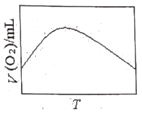 B.
B.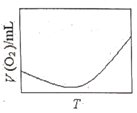
C.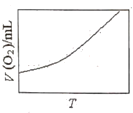 D.
D.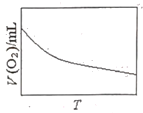
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是原子序数依次增大的短周期元素,且
是原子序数依次增大的短周期元素,且![]() 原子序数之和是
原子序数之和是![]() 原子序数之和的
原子序数之和的![]() 。甲、乙、丙、丁是由这些元素组成的二元化合物,
。甲、乙、丙、丁是由这些元素组成的二元化合物,![]() 是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物
是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物![]() 是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是
是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是
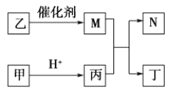
A. 由四种元素形成的两种盐,水溶液中反应能生成![]()
B. ![]() 与
与![]() 形成的化合物中阴、阳离子个数比可为1:1
形成的化合物中阴、阳离子个数比可为1:1
C. 化合物![]() 、乙烯使溴水褪色的原理相同
、乙烯使溴水褪色的原理相同
D. ![]() 与
与![]() 形成的化合物中,成键原子均满足8电子结构
形成的化合物中,成键原子均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法错误的是()
A. 常温常压下,4gD2O中含有的电子数为2NA
B. 42gC2H4和C4H8的混合气中含有氢原子数为6NA
C. 25℃时,pH=1的H3PO4溶液中含有H+数为0.1NA
D. H2O(g)通过Na2O2(s)使其增重bg时,反应中转移的电子数为bNA/2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com