
分析 (1)滤液中通入Cl2 是亚铁离子被氧化为铁离子,发生反应的离子方程式是Cl2+2Fe2+=2Cl-+2Fe3+;
(2)2.100mol/L200.00mL的盐酸的物质的量为:2.100mol/L×0.2L=0.42mol,所以;n(Fe)=$\frac{1}{2.1}$×0.42=0.2,所以n(Fe2+)+n(Fe3+)=0.2,根据电荷守恒,2n(Fe2+)+3n(Fe3+)=n(Cl-)=0.42mol,由此分析解答;
(3)根据反应方程式Cl2+2Fe2+=2Cl-+2Fe3+可知,n(Cl2)=$\frac{1}{2}$n(Fe2+)=$\frac{1}{2}$×0.18mol=0.09mol,由此解答.
解答 解:(1)滤液中通入Cl2 是亚铁离子被氧化为铁离子,发生反应的离子方程式是Cl2+2Fe2+=2Cl-+2Fe3+,故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;
(2)2.100mol/L200.00mL的盐酸的物质的量为:2.100mol/L×0.2L=0.42mol,所以;n(Fe)=$\frac{1}{2.1}$×0.42=0.2,所以n(Fe2+)+n(Fe3+)=0.2,根据电荷守恒,2n(Fe2+)+3n(Fe3+)=n(Cl-)=0.42mol,则:n(Fe3+)=0.02mol,n(Fe2+)=0.18mol,所以滤液中c(Cl-)=2.100mol/L,FeCl2和FeCl3的物质的量之比为0.18mol:0.02mol=9:1,故答案为:2.100mol/L;9:1;
(3)根据反应方程式Cl2+2Fe2+=2Cl-+2Fe3+可知,n(Cl2)=$\frac{1}{2}$n(Fe2+)=$\frac{1}{2}$×0.18mol=0.09mol,则V(Cl2)=0.09mol×22.4L/mol=2.016L,故答案为:2.016.
点评 本题考查化学方程式计算和离子方程式的书写,计算过程中学生要注意守恒知识的运用,比较基础,明确发生的反应即可解答.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | CH3COOH═CH3COO-+H+ | ||
| C. | AgCl═Ag++Cl- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚有一定毒性,可以作消毒剂和防腐剂 | |
| B. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 | |
| C. | 用食醋去除水壶中的水垢时所发生的是水解反应 | |
| D. | 木糖醇是一种新型的甜味剂,适合糖尿病患者的需要 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NF3是氧化剂,H2O是还原剂 | |
| B. | NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 | |
| C. | 一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染 | |
| D. | 若生成0.2 mol HNO3,则转移0.2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
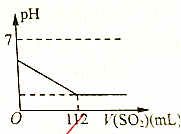 在标准状况下,向100mL新配制的氯水中通入SO2气体,SO2被氧化成硫酸,溶液的pH值变化如图所示,则原氯水的物质的量浓度为( )
在标准状况下,向100mL新配制的氯水中通入SO2气体,SO2被氧化成硫酸,溶液的pH值变化如图所示,则原氯水的物质的量浓度为( )| A. | 0.5mol/L | B. | 0.05mol/L | C. | 1mol/L | D. | 0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定没有甲烷 | B. | 混合气体中一定有甲烷和乙烯 | ||
| C. | 混合气体中可能有乙烯 | D. | 混合气体中一定有乙炔和丙炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com