
| A. | 只有②③④ | B. | 只有⑤ | C. | 只有③④ | D. | 全部 |
分析 ①浓硫酸具有吸水性、浓盐酸具有挥发性;
②依据浓硫酸的脱水性,氢氟酸能够与玻璃中二氧化硅反应的性质解答;
③依据二氧化硫漂白性与还原性解答;
④依据浓硫酸的酸性、强氧化性解答;
⑤浓硫酸具有强的氧化性,常温下与铁发生钝化,浓硫酸具有强氧化性,加热条件下能够与碳发生氧化还原反应.
解答 解:①浓硫酸具有吸水性,能吸收空气中的水分而使其溶液浓度减小,浓盐酸具有挥发性,能挥发导致溶液浓度降低,所以二者原理不同,故①错误;
②浓硫酸能在白纸上写字体现脱水性,氢氟酸能和二氧化硅反应生成四氟化硅和水,氢氟酸体现酸性,所以二者原理不同,故②错误;
③二氧化硫能和有色物质反应生成无色物质而体现漂白性,二氧化硫能被强氧化剂溴氧化生成硫酸,溴被还原生成HBr,二氧化硫体现还原性,所以二者原理不同,故③错误;
④氨气和碘化氢气体均不能用浓硫酸干燥,前者是因为氨气与硫酸反应生成盐,后者是因为发生氧化还原反应,二者原理不同,故④错误;
⑤浓硫酸具有强的氧化性,常温下与铁发生钝化,所以可以用铁容器存放浓硫酸,浓硫酸具有强氧化性,加热条件下能够与碳发生氧化还原反应,故⑤正确;
故选:B.
点评 本题综合考查元素化合物知识,侧重于基础知识的考查,难度不大,注相关基础知识的积累,把握相关物质的性质.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | X与W的最高正价之和为11 | |
| B. | Y的氢化物的稳定性比W的强 | |
| C. | 原子半径由大到小的顺序为W、Z、Y、X | |
| D. | Y分别与X、Z形成的化合物中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
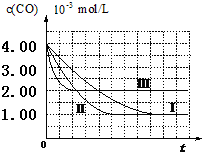 (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 6.50×10-3 | 4.00×10-3 | 120 | |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁离子的电子式:Mg2+ | B. | HF的电子式:H:F | ||
| C. | Cl-离子的结构示意图: | D. | NH4Cl的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ②⑥⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com