
【题目】二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是
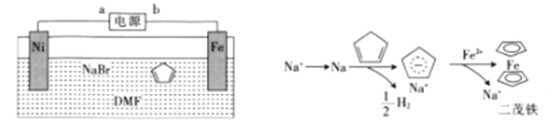
A.a为电源的正极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.二茂铁制备过程中阴极的电极反应为2H++2e-=H2↑
D.电解池的总反应化学方程式为Fe+2C5H6![]() Fe(C5H5)2+H2↑
Fe(C5H5)2+H2↑
【答案】D
【解析】
由二茂铁的电化学制备装置与原理可知,与电源正极b相连的铁为电解池的阳极,铁失电子发生氧化反应生成亚铁离子,与电源负极a相连的镍为电解池的阴极,钠离子在阴极上得电子发生还原反应生成钠,钠与![]() 发生置换反应生成
发生置换反应生成![]() 和氢气,
和氢气,![]() 与亚铁离子反应生成二茂铁和钠离子,制备二茂铁的总反应方程式为Fe+2C5H6
与亚铁离子反应生成二茂铁和钠离子,制备二茂铁的总反应方程式为Fe+2C5H6![]() Fe(C5H5)2+H2↑。
Fe(C5H5)2+H2↑。
A.由分析可知,a为电源的负极,b为电源的正极,故A错误;
B.与电源负极a相连的镍为电解池的阴极,钠离子在阴极上得电子发生还原反应生成钠,钠能与水反应,则电解质溶液不可能为NaBr水溶液,故B错误;
C. 二茂铁制备过程中阴极上钠离子得电子发生还原反应生成钠,电极反应式为Na++e-=Na,故C错误;
D. 由分析可知,制备二茂铁的总反应方程式为Fe+2C5H6![]() Fe(C5H5)2+H2↑,故D正确;
Fe(C5H5)2+H2↑,故D正确;
故选:D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Na、Fe、N是中学化学常见的三种元素,请依据这些元素组成的物质回答下列问题:
(1)钠可以和TiCl4反应制取金属Ti,体现钠的__性。
(2)氯碱工业是利用电解氯化钠溶液制取烧碱和氯气,其反应为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,该反应的离子方程式___;氯气有毒,可以用__吸收。
2NaOH+Cl2↑+H2↑,该反应的离子方程式___;氯气有毒,可以用__吸收。
(3)写出Fe2O3的一种用途__,请设计实验证明赤铁矿中含有铁元素___。
(4)电子工业常用FeCl3溶液刻蚀印刷电路板(由高分子材料和铜箔复合而成),离子方程式为__。
(5)将一小块Cu片放入盛有稀硝酸的试管中,可观察到试管口气体颜色为__;其铜和稀硝酸反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向20mL 0.1mol·L-1MOH溶液中滴加0.1mol·L-1 CH3COOH溶液,所得溶液的pH(对应曲线M)及导电能力(对应曲线N)变化如图所示。下列叙述正确的是( )
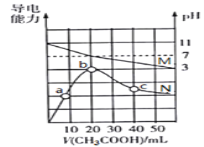
A. MOH是强碱
B. b点溶液中,c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
C. 水的离子积常数Kw:b>c>a
D. c点溶液中,c(CH3COO-)>c(M+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
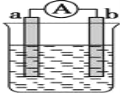
(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为:__________
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该装置__________(填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极材料:__________。当反应中收集到标准状况下224mL气体时,消耗的电极质量为__________g。
(3)燃料电池工作原理是将燃料和氧化剂(如O2)反应产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解液;则甲烷应通入________极(填a或b,下同),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及碳氧化物是许多城市大气污染的主要污染物。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1=393.5kJ·mol1
2C(s)+O2(g)=2CO(g) △H2=221.0kJ·mol1
N2(g)+O2(g)=2NO(g) △H3=+180.5kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式___。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
下列能说明该反应已经达到平衡状态的是___(填字母代号)。
A.![]() 比值不变
比值不变
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图2所示。
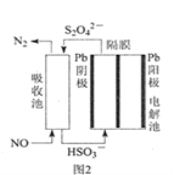
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式___。用离子方程式表示吸收池中除去NO的原理___。
(4)T1温度时在容积为2L的恒容密闭容器中发生反应:2CO(g)+O2(g)![]() 2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(CO)/mol | 2 | 1.2 | 0.8 | 0.4 | 0.4 | 0.4 |
n(O2)/mol | 1.2 | 0.8 | 0.6 | 0.4 | 0.4 | 0.4 |
①T1温度时![]() =___L/mol。
=___L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__T1(填“>”、“<”或“=")。
II.“低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题。在0.1MPa、Ru/TiO2催化下,将一定量的H2和CO2置于恒容密闭容器中发生反应X:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0
(5)温度为T时,向10L密闭容器中充入5molH2和CO2的混合气体,此时容器内压强为5P,两种气体的平衡转化率ɑ与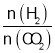 的关系如图所示:
的关系如图所示:
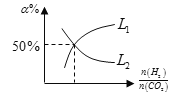
①图中CO2的平衡转化率可用表示___(L1或L2)
②该温度下,反应X的平衡常数Kp=___。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1 NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=![]() ]如图所示:
]如图所示:
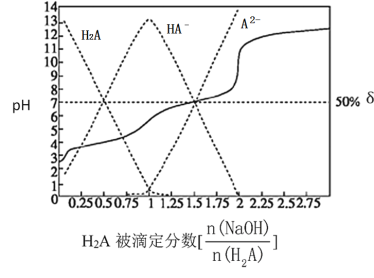
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1 NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1 NaHA溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)
C.0.1 mol·L-1 Na2A溶液中:c(Na+)<c(HA-)+2c(A2-)
D.H2A的K2=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅高温陶瓷材料是现代重要的结构陶瓷,因其有硬度大、熔点高、化学性质稳定等特点而受到广泛关注。工业上普遍用下列流程进行生产:
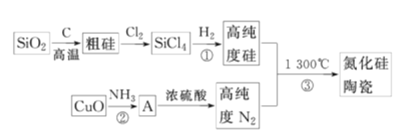
(1)SiO2和C反应除了得到粗硅外,还有可能得到一种硬度也很大的物质SiC,是生成粗硅还是生成该物质主要是由___决定的。
(2)反应①的条件是隔绝空气和____。
(3)写出制粗硅的反应的化学方程式____。
(4)写出硅与氢氧化钠溶液的离子方程式____。
(5)现在是用四氯化硅、氮气、氢气在稀有气体保护下加强热,得到纯度较高的氮化硅,其反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.15mol的MnO2与过量的12mol/L的浓盐酸反应,与50ml 12mol/L的浓盐酸与过量MnO2反应,两者产生的氯气相比(其它反应条件相同)
A.一样多 B.前者较后者多 C.后者较前者多 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的 H2S 通过高温热分解可制取氢气:2H2S(g) ![]() 2H2(g)+S2(g)。现在 3L 密闭容器中,控制不同 温度进行 H2S 分解实验。
2H2(g)+S2(g)。现在 3L 密闭容器中,控制不同 温度进行 H2S 分解实验。
(1)某温度时,测得反应体系中有气体 1.31mol,反应 tmin 后,测得气体为 1.37mol,则 tmin 内 H2 的生成 速率为___________________。
(2) 某温度时,可作为判断反应达到平衡的标志依据是_____(选填编号)。
a. 气体的压强不发生变化 b. 气体的密度不发生变化
(3)实验结果如图。图中曲线 a 表示 H2S 的平衡转化率与温度关系,曲线b 表示不同温度下、反应经过相同时间且未达到化学平衡时 H2S 的转化率。

该反应为________反应(填“放热”或“吸热”)。在容器体积不变的情况下, 如果要提高 H2的体积分数,可采取的一种措施是_______________________
(4)使 1LH2S 与 20L 空气(空气中 O2 体积分数为 0.2)完全反应后恢复到室温,混合气体的体积是________L。若 2gH2S 完全燃烧后生成二氧化硫和水蒸气,同时放出 29.4kJ 的热量,该反应的热化学方程式是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com