
【题目】下列生实验事实或结论均正确的是
选项 | 事实 | 结论 |
A | 将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液,先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小 |
B |
| 记录滴定终点读数为12.20mL |
C | Mg(OH)2固体在溶液中存在平衡: Mg(OH)2(s) | 该固体不溶于NH4Cl溶液 |
D | 镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生同时测得溶液的pH为8.6 | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生,弱碱性溶液中OH- 氧化了Mg |
A. A B. B C. C D. D
【答案】A
【解析】试题分析:A.将0.1molL-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,说明NaOH完全反应,再滴加0.1molL-1CuSO4溶液,先有白色沉淀生成后变为浅蓝色沉淀,说明发生了沉淀的转化,溶度积大的物质向溶度积小的物质转化,所以Cu(OH)2的溶度积比Mg(OH)2的小,故A正确;B.滴定管的刻度由上而下标注,根据图像,滴定管的读数为11.80 mL,故B错误;C.加入NH4Cl溶液,氢氧根离子浓度减小,促进氢氧化镁的溶解平衡正向移动,使得,氢氧化镁溶解,故C错误;D. 若是氢氧根氧化了Mg,则氢氧根得电子被还原,碱性环境下,金属镁参与的反应不可能生成气体(氢气),所以D的结论不合理,故D错误;故选A。


 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】我国科技创新成果斐然,下列成果中获得诺贝尔奖的是( )
A.徐光宪建立稀土串级萃取理论
B.屠呦呦发现抗疟新药青蒿素
C.闵恩泽研发重油裂解催化剂
D.侯德榜联合制碱法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为5种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的位置如图。下列说法不正确的是
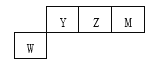
A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z,沸点:X2Z>YX3
C. X、Y、Z三种元素形成的化合物中不可能含离子键
D. YM3、WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基础填空
(1)0.25molCaCO3的质量为_______g(Ca-40 C-12 O-16)。
(2)在标准状况下,含有1.806×1024个氢原子的氢气的体积为________L。
(3)现有下列物质:属于电解质的是________(填序号,下同);属于非电解质的是__________。
①CO2 ②NaCl溶液 ③Mg ④NaOH
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应生成Fe(OH)3胶体。
①在高铁酸钾中,Fe的化合价为______________。
②将此离子反应补充完整:4FeO42-+10H2O=Fe(OH)3(胶体)+3O2+___________;此反应属于________(填“氧化还原反应”或“非氧化还原反应”)
③实验室中制取的Fe(OH)3胶体中常常含有杂质Cl-离子,可用______(2个字)的方法除去Fe(OH)3胶体中混有的杂质Cl-离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据报道,我国某些地区的酸雨严重,为了改变这一状况,某市正准备推广使用清洁能源.下列不是清洁能源的是
A. 太阳能 B. 天然气 C. 煤 D. 酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有MgCl2、NaCl、Na2SO4三种物质的混合溶液,其中含有Cl-为1.8mol,Na+为2mol,Mg2+为0.5mol,则SO42-的物质的量为
A.0.6mol B.0.7mol C.1.2mol D.1.0mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A.NaHSO4溶液中加入过量Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.次氯酸钙溶液中加入亚硫酸钠:SO32-+Ca2+=CaSO3↓
C.NH4HCO3溶液中加足量NaOH溶液共热:HCO3-+NH4++2OH-![]() CO32-+NH3↑+2H2O
CO32-+NH3↑+2H2O
D.硫酸亚铁溶液中加入用硫酸酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 以下三组溶液:①煤油和硫酸钾溶液 ②42%的乙醇溶液 ③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:

(1)写出AlCl3与氨水反应的化学反应方程式_________________________。
(2)判断流程中沉淀是否洗净所用的试剂是 ,高温焙烧时,用于盛放固体的仪器名称是 。
Ⅱ、无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

(3)其中装置A用来制备氯气,写出其离子反应方程式:______________________。
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是__________________________。
(5)F中试剂是________。G为尾气处理装置,其中反应的化学方程式:__________________。
(6)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案 (填“可行”,“不可行”),理由是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com