
【题目】下列碳原子的物质的量为1 mol的是( )
A. 0.012 kg C B. 0.012 kg12C
C. 0.012 kg13C D. 0.012 kg12C和13C
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ:报据下列有关图象,回答有关问题:
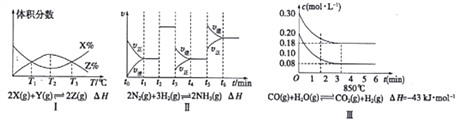
(1)由图I知,该反应的△H__________0(填“>”或“<”〉)
(2)由图Ⅱ知,反应在________时刻,NH3体枳分数最大(填t1~t2或t2~t3或t3~t4或t4~t5或t5~t6)
(3)图Ⅲ表示在10L容器、850℃时的反应,由图知,到4min时,反应放出的热量为___________。
Ⅱ: 25℃时,将体积为Va、pH=ɑ的某一元强酸与体积为Vb、pH=b的某一元强碱混合,且己知ɑ=0.56,
Va请完成下列各题。
(1)ɑ是否可以等于3 (填“是”或“否”)____________。
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00mLKOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11mL。则b=___________。
(3)若己知酸是强酸,碱是强碱,酸和碱恰好中和,则ɑ的取值范围是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种有机玻璃的结构简式为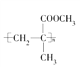 。下列关于它的叙述中不正确的是( )
。下列关于它的叙述中不正确的是( )
A. ![]() 在一定条件下发生缩聚反应即可合成该有机玻璃
在一定条件下发生缩聚反应即可合成该有机玻璃
B. 该有机玻璃能发生氧化反应
C. 合成该有机玻璃的原料可能有甲烷
D. 它在一定条件下发生水解反应时C—O键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
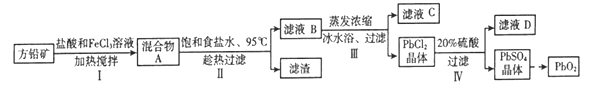
【题目】铅蓄电池有广泛的应用,由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:
査阅资料:①PbCl2(s)+2Cl-(aq) ![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
②Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9、7.0
③不同温度和浓度的食盐溶液中PbCl2的溶解度(g L-1):
| 20 | 40 | 60 | 100 | 180 | 260 | 300 |
13 | 3 | 1 | 0 | 0 | 3 | 9 | 13 |
50 | 8 | 4 | 3 | 5 | 10 | 21 | 35 |
100 | 17 | 11 | 12 | 15 | 30 | 65 | 95 |
(1)步骤I中FeCl3溶液与PbS反应生成PbCl2和S的化学方程式为__________________;
加入盐酸控制pH小于1.0的原因是________。
(2)步骤II中浸泡溶解时采用95℃和饱和食盐水的目的分别是____________、_____________。
(3)步骤III中将滤液B蒸发浓缩后再用冰水浴的原因是___________(请用平衡移动原理解释)。
(4)骤IV需用溶质质量分数为20%、密度为1.22 g·cm-3的硫酸溶液,现用溶质质量分数为98.3%、密度为1.84 g·cm-3的浓硫酸配制,需用到的玻璃仪器有___________ (填相应的字母)。
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒 F.胶头滴管
(5)用铅蓄电池为电源,采用电解法分开处理含有Cr2O72-及含有NO2-的酸性废水(最终Cr2O72-转化为Cr(OH)3, NO2-转化为无毒物质),其装置如下图所示。
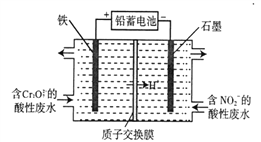
①左池中Cr2O72-转化为Cr3+的离子方程式是__________________。
②当阴极区消耗2 mol NO2-时,右池减少的H+的物质的量为______________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
A | 有三个电子层,K,M层电子数之和等于L层电子数 |
B | 短周期中金属性最强 |
C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
D | 元素最高正价是+7价 |
(1)用化学用语回答下列问题:
①A元素在周期表中的位置;
②C单质分子的电子式;
③D的原子结构示意图;
④电子式表示A和B元素组成的化合物的形成过程: .
(2)元素D与元素A相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A,B,C,D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去). ![]()
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,有白色沉淀生成,则该白色沉淀为 , 试写出Y与H2O2溶液反应的化学方程式:;
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料。
Ⅰ、某学习小组同学设计了下图所示的实验装置(部分夹持仪器未画出),进行氨气实验室制备且探究氨气的还原性及产物的检验。
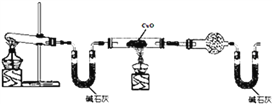
实验现象为:黑色CuO变为红色;干燥管中无水CuSO4粉末变为蓝色;同时生成一种无色无味无污染的气体。
(1)请写出大试管中反应的化学方程式_______________________________________。
(2)请写出氨气与CuO反应的化学方程式_________________________________________。
(3)该装置存在明显缺陷,请指出存在的问题______________________。
Ⅱ、哈伯因为将氮气和氢气在一定条件下合成氨气的成果面获得1918年诺贝尔化学奖。现将1molN2和3molH2充入一恒容的密闭容器中,使其在一定条件下达到平衡N2+3H2![]() 2NH3,下列哪些状态一定是达到平衡的状态?(_____)
2NH3,下列哪些状态一定是达到平衡的状态?(_____)
A.混合气体的平均相对分子质量不随时间改变而改变的状态
B.N2、H2、NH3的总物质的量不随时间改变而改变的状态
C.混合气体的密度不随时间改变而改变的状态
D.单位时间内0.1molNH3分解的同时,有0.05molN2生成的状态
Ⅲ、下图是一种电化学制备NH3的装置,图中陶瓷在高温时可以传输H+。
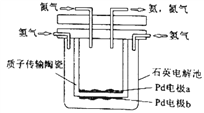
(1)H+经质子传输陶瓷由_____________流向_______________。(选填“a”或“b”)
(2)阴极发生的电极反应为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素的性质递变规律,
图2中A,B,C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.(已知常温下浓盐酸与高锰酸钾能反应生成氯气).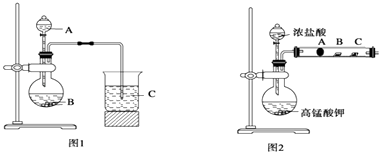
(1)甲同学设计的实验,固体B为大理石,试剂A为(填序号);
①稀硝酸 ②浓盐酸 ③NaOH溶液 ④Na2SiO3溶液
(2)写出图1烧瓶中发生反应的离子方程式;
(3)甲同学所做实验图1烧杯中现象为;
(4)乙同学所做实验图2中B处的现象为;
(5)写出图2中A处发生反应的离子方程式;
(6)乙同学用图2来完成实验验证卤素单质氧化性:Cl2>Br2>I2 , 你认为合理吗?(填“合理”或“不合理”)理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是
A. 植物油不能发生水解反应 B. 淀粉水解的最终产物是葡萄糖
C. 葡萄糖能发生氧化反应和水解反应 D. 蛋白质水解的产物为纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在碱性条件下可以大量共存,而在强酸性条件下能发生氧化还原反应的是( )
A.Ca2+、Fe2+、NO3﹣、Cl﹣
B.Ba2+、Na+、I﹣、NO3﹣
C.Na+、K+、SO42﹣、SO32﹣
D.K+、Mg2+、HCO3﹣、PO43﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com