
 近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:| 容器代号 | NO | N2 | O2 |
| A | 2 | 0 | 0 |
| B | 0 | 1 | 1 |
| C | 0.4 | 0.6 | 0.8 |
| D | 1 | 0.5 | 0.4 |
分析 (1)N2(g)+O2(g)?2NO(g),
c(初) 1 1 0
c(变) x x 2x
c(平) 1-x 1-x 2x
所以$\frac{2x}{2}$=0.0075,解之得x=0.0075mol,由此数据,结合相关公计算求解;
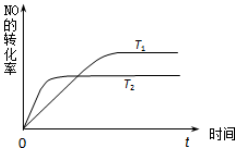
(2)①由图可知T2大于T1,而温度越高一氧化氮的转化率越小,所以正反应是放热反应;
②可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
③A将一氧化氮完全转化为氮气和氧气,相当于投氮气和氧气都是1mol,所以A和B是同一平衡,而C用极端相当于投氮气0.8mol和1mol的氧气,所以C相当在A和B平衡的基础上减少氮气的量,平衡逆向移动,所以氮气的体积分数减小,D用极端转化相当于投氮气1mol和0.8mol的氧气,所以D相当在A和B平衡的基础上减少氧气的量,平衡逆向移动,所以氮气的体积分数最大;
(3)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1;②CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;而CH4与NO反应生成N2、CO2、H2O(g)的反应方程式为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g),根据盖斯定律可知:△H=2②-①=-867×2+574═-1160kJ/mol,由此书写热化学方程式;
②一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,即二氧化碳和氮气,由此书写化学方程式.
解答 解:(1)N2(g)+O2(g)?2NO(g),
c(初) 1 1 0
c(变) x x 2x
c(平) 1-x 1-x 2x
所以$\frac{2x}{2}$=0.0075,解之得x=0.0075mol;则该反应在5 min内的平均反应速率v(O2)=$\frac{0.0075}{5}$=0.0015mol•L-1•min-1,N2的平衡转化率为$\frac{0.0075}{1}×100%$=0.75%,2 000 K时该反应的平衡常数K=$\frac{(2×0.0075)^{2}}{(1-0.0075)^{2}}$=2.25×10-4,
故答案为:0.0015; 0.75%; 2.25×10-4;
(2)①由图可知T2大于T1,而温度越高一氧化氮的转化率越小,所以正反应是放热反应,故答案为:放热;
②a.两边计量数相等,容器内的压强一直不发生变化,故错误;
b.混合气体的密度一直不发生变化,故错误;
c.NO、N2、O2的浓度保持不变,说明正逆反应的速率相等,达平衡状态,故正确;
d.单位时间内分解4mol NO,同时生成2molN2,都体现逆反应的方向,故错误;
故选:c;
③A将一氧化氮完全转化为氮气和氧气,相当于投氮气和氧气都是1mol,所以A和B是同一平衡,而C用极端相当于投氮气0.8mol和1mol的氧气,所以C相当在A和B平衡的基础上减少氮气的量,平衡逆向移动,所以氮气的体积分数减小,D用极端转化相当于投氮气1mol和0.8mol的氧气,所以D相当在A和B平衡的基础上减少氧气的量,平衡逆向移动,所以氮气的体积分数最大,则氮气的体积分数大小顺序为:D>A=B>C,故选:D;
(3)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1;②CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;而CH4与NO反应生成N2、CO2、H2O(g)的反应方程式为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g),根据盖斯定律可知:△H=2②-①=-867×2+574═-1160kJ/mol,所以热化学方程式为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol,
故答案为:CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol;
②一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,即二氧化碳和氮气,所以化学方程式为2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2,
故答案为:2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2.
点评 本题考查化学平衡移动、盖斯定律的运用和化学方程式的书写,为高频考点,特别是(2)③等效平衡的运用,侧重分析与应用能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,Zn板应与外接电源的负极相连 | |
| B. | 放电时,溶液中的OH从正极向负极移动 | |
| C. | 正极反应式为:FeO42-+3e-+4H2O═Fe(OH)3+5OH- | |
| D. | 充电时,当转移0.2mol电子时,阴极质量增加3.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.8g熟石膏(2CaSO4•H2O)含有的结晶水分子数为0.02NA | |
| B. | 1mol CnH2n-2(n≥2)中所含的共用电子对数为(3n+1)NA | |
| C. | 60克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2 | |
| D. | 在K37ClO3+6H35Cl(浓)═KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由W和X两种元素形成的化合物可能含有非极性共价键 | |
| B. | 由X、Y、Z三种元素形成的化合物只能为Y2ZX2或Y2ZX4 | |
| C. | 由W、X、Y、Z四种元素形成的化合物水溶液可能呈强酸性 | |
| D. | W、X、Y、Z四种元素两两之间形成二元化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠原子的结构示意图: | |
| B. | 过氧化钠的电子式: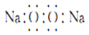 | |
| C. | 小苏打在水中的电离方程式:NaHCO3═Na++HCO3- | |
| D. | 硫化钠的水溶液呈碱性的原因:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
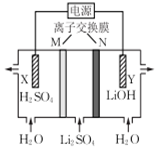
| A. | X电极连接电源负极 | |
| B. | N为阳离子交换膜 | |
| C. | Y电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 制备2.4 g LiOH产生的H2在标准状况下为2.24 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com