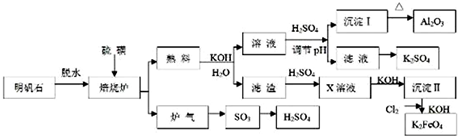
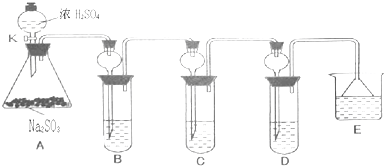
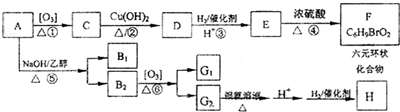
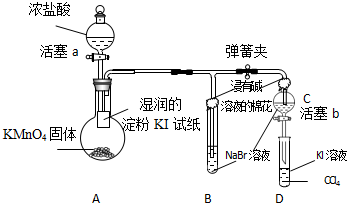
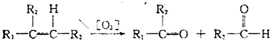随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点.“碳一化学”即以单质碳及CO、CO
2、CH
4、CH
3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
(1)将CO
2转化成有机物可有效实现碳循环.CO
2转化成有机物的例子很多,如:
a.6CO
2+6H
2O
C
6H
12O
6b.CO
2=3H
2CH
3OH+H
2O
c.CO
2+CH
4CH
3COOHd.2CO
2+6H
2CH
2=CH
2+4H
2在以上属于人工转化的反应中,原子利用率最高的是
(填序号).
(2)CO可用于合成甲醇.在压强0.1MPa条件下,在体积为bL的密闭容器中充入amolCO和2amolH
2,在催化剂作用下合成甲醇:CO(g)+2H
2(g)?CH
3OH(g).平衡时CO的转化率与温度、压强的关系如图.
①该反应属于
反应(填“吸热”或“放热”).若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是
(填序号).
a.反应使用催化剂意义不大
b.该反应发生将在很短时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
②100℃时,该反应的平衡常数K=
(用a,b的代数式表示).
(3)二甲醚(CH
3OCH
3)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
①工业上利用水煤气合成二甲醚的三步反应如下:
a.2H
2(g)+CO(g)?CH
3OH(g)△H
1=-90.8kJ.mol
-1b.2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)△H
2=-23.5kJ.mol
-c.CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H
3=-41.3kJ.mol
总反应:3H
2(g)+3CO(g)?CH
3OCH
3(g)+CO
2(g)的△H=
.
②对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是
(填字母).
a.n(CH
3OH)=n(CH
3OCH
3)=n(H
2O)
b.容器内压强保持不变
c.H
2O(g)的浓度保持不变
d.CH
3OH的消耗速率与CH
3OCH
3的消耗速率之比为2:1
(4)以KOH溶液为电解质,用二甲醚-空气组成燃料,其中负极的电极反应式为
.
(5)C1化合物在治理汽车尾气方面也大有可为,如CO、CH
4等在一定条件下均可以与氮氧化物生成无污染的物质.写出CO与氮氧化物(NO
x)在有催化剂的条件下反应的化学方程式
.

 随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.