
| A. | 单位时间内生成nmolA2,同时消耗2n molAB | |
| B. | 容器中各组分的体积分数不随时间变化容器内 | |
| C. | AB的消耗速率等于A2的消耗速率 | |
| D. | 3种气体AB、A2、B2共存 |
分析 化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,注意化学方程式的特点是反应前后气体体积改变的反应.
解答 解:A、生成nmolA2,同时消耗2n molAB,都是正反应速率,无法证明正逆反应速率相等,故A错误;
B、各组分的体积分数不随时间变化,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C、AB与A2的化学计量数不同,AB的消耗速率等于A2的消耗速率时,正逆反应速率不同,不能证明反应达到平衡状态,故C错误;
D、可逆反应的反应物和生成物共存时,反应不一定达到平衡状态,故D错误;
故选B.
点评 本题利用一些基本量来判断一个可逆反应是否达到化学平衡状态,判断时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{4}{5}$v(NH3)=v(O2) | B. | $\frac{4}{5}$v(O2)=v(NO) | C. | $\frac{5}{6}$ v(O2)=v(H2O) | D. | $\frac{2}{3}$v(NH3)=v(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 乙烯基乙炔能与Br2发生加成反应 | |
| C. | 乙烯基乙炔分子内含有两种官能团 | |
| D. | 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12gC所具有的能量一定高于28gCO所具有的能量 | |
| B. | 56gCO和32gO2所具有的总能量大于44gCO2所具有的总能量 | |
| C. | 12gC和32gO2所具有的总能量大于44gCO2所具有的总能量 | |
| D. | 将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
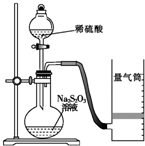 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
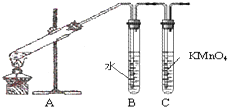 为探究溴乙烷与NaOH乙醇溶液发生反应后生成的气体中是否含不饱和烃的装置如图所示.回答:
为探究溴乙烷与NaOH乙醇溶液发生反应后生成的气体中是否含不饱和烃的装置如图所示.回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com